<small id="4uu6s"></small>

繼重慶市食藥監局在8月31日早間7點更新日前官方網站上發布的重慶醫藥工業研究院舉報信回復后,8月31日發現,在重慶市藥監局官網上,相關舉報信已經找不到蹤跡,點開此前保存的該郵件地址后出現彈窗“對不起,未找到該郵件”。[詳情]

復星醫藥二級子公司遭舉報事件有了新進展。8月31日早間和8月30日深夜,重慶市食品藥品監管局(以下簡稱重慶食藥監局)和復星醫藥相繼發布最新進展或說明。[詳情]

8月31日,復星醫藥開盤大跌,最低價報28.22元,較昨日收盤價跌幅10%。復星醫藥控股子公司重慶醫藥工業研究院(重慶醫工院)被舉報一事遭到媒體廣泛關注。[詳情]

8月30日晚間,復星醫藥披露關于媒體報道說明公告,就近日重慶食藥監局收到有關《重慶醫藥工業研究院制藥公司嚴重違反藥品管理法》的信件作出回應。[詳情]

近日,重慶市食品藥品監管局(簡稱“重慶食藥監局”)公開信箱顯示收到有關“重慶醫藥工業研究院制藥公司嚴重違反藥品管理法”的信件(簡稱“信件”)。針對上述信件內容,經自查核實,復星醫藥已于8月30日晚發布公告就相關情況進行說明。[詳情]

繼長春長生生物違法違規生產狂犬疫苗事件引發輿論強烈關注后,復星醫藥旗下公司被爆出違規生產藥品,編造生產記錄、檢驗記錄等現象。[詳情]

復星醫藥孫公司被質疑弄虛作假,今日復星醫藥H股開盤跌5.71%,報價31.4港元;母公司復星國際跌1.1%,聯營公司國藥控股無升跌。[詳情]

昨日,有媒體報道稱重慶醫藥工業研究院制藥公司內部員工向重慶食藥監局舉報,該公司嚴重違反藥品管理法,甚至在“在違反國家藥品生產管理法規方面比長春長生生物有過之無不及”。[詳情]

復星醫藥旗下公司被食藥監部門調查,受此消息影響,復星醫藥今日集合競價大幅低開近8%,截止發稿,復星醫藥報29.01元。[詳情]





復星醫藥旗下公司被食藥監部門調查,受此消息影響,復星醫藥今日集合競價大幅低開近8%,截止發稿,復星醫藥報29.01元。[詳情]






老板們要小心了 現在流行員工舉報 【顧盼生思】 政府管理部門不應只在收到舉報后痛下殺手,而要注重長效管理。 顧惠忠 長生生物員工舉報捅出了疫苗事件,上周又有復星醫藥旗下企業員工向重慶藥監局舉報,說公司存在編造生產記錄、騙取GMP證書等嚴重違規問題。而據我們所知,還有別的醫藥上市公司員工舉報“東家”,只是舉報的方向不同。粗看起來,現在似乎很流行員工舉報,而且,對準的都是企業的“生死穴”。 長生事件處理一批省部級官員,給地方首腦及分管領導、國家主管部門極大的震撼,加大了對企業的監管力度。前幾天,筆者走訪疫苗企業時聽說當地政府在長生事件后隔三岔五就到公司來檢查一次,還在考慮派駐廠監督員。所以,現在只要有員工舉報企業,主管部門和地方政府一定會嚴查,而不會過多地考慮是否影響地方經濟。復星醫藥子公司員工舉報發生后,國家藥監局立馬派督查組監督重慶藥監局的調查,也足以說明現今政府對企業重大違法違規行為的零容忍。 證券市場對公司出現的風險苗頭更是零容忍,機構們一有風吹草動“撒腿”就跑,直接讓股價“死給”老板們看。 所以,老板們對員工舉報現象要高度重視。 員工舉報“東家”的直接動因往往是認為個人利益受損或未得到保障,長生生物事件就是因為有老員工因為加班費不公而舉報。所以,老板們要善待員工,首先的一條是要給員工合理的報酬,要給員工好的激勵。前段時間筆者訪談了安科生物董事長宋禮華。2009年上市以來,安科生物每年的業績持續保持兩位數以上的增長。在說到有何秘訣時,宋禮華告訴筆者,重要的一點是公司的體制。安科生物經過幾次員工激勵,把公司打造成全體骨干持股的模式。現在的安科生物不僅僅是一家公眾公司,更是一家員工持股的上市公司,2000多員工持有公司股份。宋禮華說,這是他們的核心保障。企業在良性發展的過程當中,股票對于每一個員工、每一個骨干來說是一個“定心丸”,大家更容易捆綁在一起。 現今宏觀趨勢嚴峻,很多企業在開源節流,而“節流”如果操作不當容易引起員工不滿,極易引來舉報。 當然了,如果企業自身過硬就不怕員工舉報。所以,企業在做好員工激勵的同時,更要在經營上合法守規。老板們既要把握好企業整體的合法經營,也要通過技術手段等促使員工合法合規操作,甚至防范個別員工故意搗亂、先搗亂再舉報。如藥品生產企業要通過在每個流程、每臺設備上加裝不可更改數據的監控設施來嚴格嚴密管控整個生產流程,防范因為員工的不當操作而給企業帶來滅頂之災。這可能會增加企業經營成本,但與生存風險相比,這個投入是必要的。何況以設備的智能化減少了人的使用,除了一次性投入較大外,真正的成本并不一定高。 而政府管理部門也不應只在收到舉報后痛下殺手,而要注重長效管理。如前面說的藥品生產,藥監部門的監控系統應該盡可能地與企業的設備改進匹配,要出臺相應的指引或規劃,不要在企業設備改造后再搞一套系統,人為地增加企業成本。 (作者系證券時報記者)[詳情]

復星醫藥二級子公司遭舉報 重慶食藥監局稱一直未能聯系上舉報人 每經記者 陳晴 每經編輯 張海妮 長生疫苗案后,醫藥領域又出現員工舉報企業造假。8月30日,每日經濟新聞獨家報道,重慶醫藥工業研究院有限責任公司的員工,通過重慶市食品藥品監管局網站,舉報公司編造生產記錄、檢驗記錄,騙取藥品GMP證書等情況。 而重慶醫藥工業研究院有限責任公司是復星醫藥的子公司。該事件一出,引起各方關注。國家藥監局迅速派出督查組,對調查工作進行督查。復星醫藥也緊急發布澄清公告。那么,被舉報的重慶醫藥工業研究院有限責任公司的情況究竟怎樣?剛剛過去的這個周末,我們的記者進行了實地探訪。 復星醫藥(600196,SH)二級子公司重慶醫藥工業研究院有限責任公司(以下簡稱重慶醫工院)遭舉報事件有了新進展。8月30日深夜和8月31日早間,復星醫藥和重慶市食品藥品監管局(以下簡稱重慶食藥監局)相繼發布最新進展或說明。 重慶食藥監局開展調查 此次重慶食藥監局官網發布的舉報信,來自重慶醫工院內部員工,其稱“我院制藥公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及”。 舉報信提到了多方面的舉報內容,包括:重慶醫工院存在“幾乎所有生產工藝都沒有根據批準的工藝生產”“領導帶領員工大量編造生產記錄、檢驗記錄”“在2016年5月美國FDA現場檢查后,得到了警示信!”“2017年11月美國FDA再次現場檢查,又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI)”“欺騙上級藥品監督管理部門,騙取藥品GMP證書”“主要供應上海中西藥業的產品——阿力哌唑,工藝作了重大改變”“集中力量做重慶市藥監局的工作,又請吃飯,又送紅包”等行為。 對于上述舉報事件,8月31日早間,重慶食藥監局公開信箱更新了調查進展:我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前我們一直未能聯系上實際舉報人。 重慶食藥監局稱:“熱忱歡迎舉報人或知情人士負責任地向我局提供全面、客觀、詳實的證據,我們一定認真核查,依法依規嚴肅處理。” 復星醫藥深夜發布事件說明 舉報事件發生后,8月30日深夜,復星醫藥也發布了“關于媒體報道的有關情況”的說明。根據公告,重慶醫工院及其制藥公司重慶醫工院制藥有限責任公司(以下簡稱醫工院制藥)主要從事仿制藥原料藥和中間體的研發、生產和銷售,主要客戶為歐美及中國的制劑企業。其中重慶醫工院是復星醫藥的二級控股子公司。 《每日經濟新聞》記者注意到,舉報信中的部分舉報情況得到了復星醫藥的確認,例如,“在2016年5月美國FDA現場檢查后,得到了警示信!”復星醫藥稱公司曾于2017年3月發布相關公告。 不過,針對舉報信中提到的“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”,復星醫藥稱,根據醫工院制藥自查,現有產品均根據已批準的工藝進行生產。在生產過程中,對于生產工藝的調整均經相關藥監部門批準或備案。 針對舉報信中提到的“主要供應上海中西藥業的產品——阿力哌唑,工藝作了重大改變”,復星醫藥回應稱,根據經營的需要,重慶醫工院于2016年向醫工院制藥轉移了阿立哌唑、培美曲塞二鈉產品批件,于2018年轉移了蔗糖鐵產品批件,并已通過藥監部門的現場檢查和批準;醫工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報,2018年提供給上海中西三維藥業有限公司的產品僅作為其制劑研究之用。 復星醫藥還稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。[詳情]

國家藥監局:已派督查組介入重慶醫工院被舉報事件 每經記者 陳晴 每經編輯 文多 復星醫藥子公司重慶醫藥工業研究院有限責任公司(以下簡稱重慶醫工院)被內部員工舉報事件持續發酵。8月31日晚間,《每日經濟新聞》記者注意到,國家藥品監督管理局已介入。 國家藥品監督管理局官網8月31日發文稱,針對網絡反映舉報重慶醫藥工業研究院有限責任公司的情況,國家藥品監督管理局已責成重慶市食品藥品監督管理局開展徹查,盡快查清核實。如發現違法違規行為,依法嚴肅查處。調查結果及時向社會公開。國家藥監局已派出督查組,對調查工作進行督查。 重慶食藥監局官網公布的舉報信顯示,此次舉報來自重慶醫工院內部員工,舉報信中稱:“我院制藥公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及”。 舉報信中還舉例稱:重慶醫工院“幾乎所有生產工藝都沒有根據批準的工藝生產”“領導帶領員工大量編造生產記錄、檢驗記錄”,還稱“2017年11月美國FDA再次現場檢查,又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI)”“欺騙上級藥品監督管理部門,騙取藥品GMP證書”“ 集中力量做重慶市藥監局的工作,又請吃飯,又送紅包”。 針對此次舉報事件,8月31日早間,重慶食藥監局公開信箱更新的調查進展顯示:該局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的該局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前該局一直未能聯系上實際舉報人。 [詳情]

復星醫藥董事長:公司產品經得起查,若有問題將嚴肅整改完善 每經記者 徐杰 實習記者 張瀟尹 每經編輯 張海妮 日前,復星醫藥(600196,SH)旗下重慶醫藥工業研究院有限責任公司(以下簡稱重慶醫工院)遭舉報:編造生產記錄、騙取藥品GMP(生產質量管理規范)證書、存在嚴重違反國家藥品生產管理法規行為。 8月31日午間,復星醫藥就此召開媒體澄清會。會上,復星醫藥董事長陳啟宇通報稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。同時,復星醫藥進行了內部自查,目前已確認現有產品均根據已批準的工藝進行生產,對于生產工藝的調整均經相關藥監部門批準或備案,復星醫藥將實時掌握舉報和檢查的動態情況。 據陳啟宇介紹,重慶醫工院及其制藥公司主要從事仿制藥原料藥和中間體的研發、生產和銷售,復星醫藥持有其56%股份。2017年度,重慶醫工院實現營業收入7780萬元,占復星醫藥2017年度營業收入的0.42%,其年度凈虧損超過3000萬元。近兩年受內外部因素影響,重慶醫工院的經營仍處于虧損和投入的階段。 針對舉報信中“在2016年5月美國FDA現場檢查后,重慶醫工院得到了警示信”的內容,陳啟宇回應稱,公司針對該警示信已于2017年3月2日刊發了相關公告,并對時任的總經理等相關負責人給予嚴肅處理調整。彼時,重慶醫工院已形成新的領導班子,并積極推進相關整改工作。此外,陳啟宇進一步表示:“當時正值重慶醫工院新建原料藥基地和工廠搬遷,美國FDA現場檢查的是原來舊的生產設施,目前公司已經完全放棄(對)這些設施的使用。” 此外,針對8月31日上午重慶市食藥監局官網上的相關舉報信“失蹤”問題,陳啟宇回應稱,該舉報信并非“消失”,而是由于后續情況有所更新,其在會上通報了重慶市食藥監局的最新調查進展:目前重慶市食藥監局已組織主要由國家藥品GMP檢查員組成的調查組,對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的該局監管人員接受吃請、收受紅包進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前尚未聯系上實際舉報人。 陳啟宇表示復星醫藥將始終堅持以創新為導向,守住合規經營的底線。公司在多年前已建立內部飛行檢查制度,掌握第一手的生產經營情況,同時接受來自政府部門、國內外監管機構、客戶等多方位的檢查。他進一步表示:“因此‘經得起查’是我們生產經營的基本工作,若在檢查中發現問題,我們會嚴肅地加以整改和完善。” [詳情]

每經記者實探重慶醫工院:提及被舉報之事 有員工快步離開 每經記者 王琳 陳晴 每經編輯 文多 復星醫藥(600196,SH)旗下二級子公司被舉報事件引起市場震動。8月31日,復星醫藥3家相關上市公司的股價均出現不同程度下跌,其中復星醫藥股價下跌6.89%。 處在旋渦中心的主角,即復星醫藥旗下的重慶醫藥工業研究院(以下簡稱重慶醫工院)當前情況如何?8月31日,《每日經濟新聞》記者進行了實地探訪。 員工稱“事情還在調查” 據重慶醫工院官網資料,重慶醫工院成立于1950年,是當時西南地區唯一的主要從事化學藥物研究開發的專業研究開發的事業單位。2001年,作為重慶市首批科研院所轉制的單位,由上海復星醫藥產業發展有限公司與重慶醫藥(集團)股份有限公司合資組建成立重慶醫藥工業研究院有限責任公司。 根據復星醫藥8月30日晚間公告,截至公告日,重慶醫工院的注冊資本為5500萬元,其制藥公司即重慶醫工院制藥有限責任公司(以下簡稱醫工院制藥)的注冊資本為1.35億元。 8月31日上午,《每日經濟新聞》記者來到位于重慶市南岸區涂山路565號的重慶醫藥工業研究院有限責任公司。 一位自稱是藥物分析部門的員工一開始向記者表示,不知道公司被舉報的事情,但在后續聊天中該員工又表示,聽說(舉報)是虛假的,而記者詢問這個是否為公司領導的說法時,該員工僅表示:“這個事情還在調查,等結果,因為大家都說不準,只有等藥監局的過來查一下,因為生產都在長壽區,所以檢查也在長壽。” 上述員工還表示,自己不了解公司的業績,但是自己的收入一般,不好也不差。此外,記者詢問的另外兩名重慶醫工院員工中,一人表示自己不知道公司被舉報的事,另一人聽到《每日經濟新聞》記者說起舉報之事,立即快步揮手離開。 重藥控股:未參與被舉報公司生產經營 針對此次舉報事件,8月31日早間重慶食藥監局公開信箱更新的調查進展顯示:主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;發現其所留信息不是舉報人真實信息,目前一直未能聯系上實際舉報人。 調查結果未出,相關事件已引起了投資者的關注。繼復星醫藥通過公告和官方微信公眾號對事件進行說明以后,8月31日下午,有投資者在互動平臺上就此向重藥控股提出疑問。 對此,重藥控股回復稱,公司控股子公司重慶醫藥集團持有復星醫藥子公司重慶醫工院43.11%股權,僅作為財務投資,并未參與醫工院、醫工院制藥的生產經營。 被波及的不止上述兩家上市公司。舉報信稱:“主要供應上海中西藥業的產品——阿力(立)哌唑,工藝作了重大改變,不但沒有根據國家批準的工藝生產,而且經2017年11月美國FDA再次現場檢查發現了嚴重違反藥品管理法規的行為。” 《每日經濟新聞》記者查詢發現,阿立哌唑是一種主治精神分裂癥的藥物,而中西藥業曾經為A股上市公司,至2010年被上海醫藥(601607,SH)換股吸收,正式退市。 根據上海醫藥2014年和2015年年報,阿立哌唑的銷售收入分別為12629萬元和13622萬元。而此后,上海醫藥的年報中再未出現該藥名。 8月31日晚,國家藥品監督管理局官網也發文表示介入此事,并提到國家藥監局已派出督查組,對調查工作進行督查。 [詳情]

復星醫藥突遭利空盤中跌停 投資者該如何面對黑天鵝 8月30日,復星醫藥(港股02196)(600196,SH)子公司被其員工舉報至重慶市食品藥品監督局的消息被廣泛傳播。雖事件尚未有正式調查結果,復興醫藥也密集發聲以證清白,但是,復興醫藥8月31日股價應聲下跌,A股開盤觸及跌停板,收盤跌6.89%,在醫藥制造板塊跌幅榜居前。《每日經濟新聞》記者注意到,復興醫藥投資者有如驚弓之鳥的表現跟今年A股“黑天鵝”事件不無關系。 今年,市場上對退市、ST等話題的討論尤為常見,A股市場先后有四家公司退市,金亞科技因欺詐發行已被深交所啟動強制退市機制,股票存在被暫停及終止上市的風險,ST長生發出提示稱公司存暫停上市或退市風險。 出現退市風險或是被實施特別風險警示的股票股價常常會遭遇數個跌停,偶爾也出現強勢上漲的情況。對于不太了解相關流程和規定的投資者來說,在做堅定持有還是盡早逃離的選擇前搖擺不定,甚至還有投資者火中取栗后損失慘重。在A股市場中面對這類股票如何理性投資呢?《每日經濟新聞》記者下面就和大家一起學習一下。 今年以來4只票完成退市 今年A股市場上關于退市、ST等話題時有出現,這些股票股價的劇烈波動總不免引起熱議。 6月底,繼欣泰電氣后,A股第二例欺詐發行強制退市也在今年產生,那就是利用虛增收入利潤等手法騙取IPO核準的金亞科技。 而長生生物的疫苗事件可謂A股7月的“黑天鵝”。ST長生8月30日漲停、8月31日跌停的劇烈變化引起了市場的極大關注。ST長生8月30日晚發布公告表示,根據國務院會議指示,將沒收公司全資子公司長春長生生物科技有限責任公司所有違法所得并處最高罰款,巨額罰款可能會導致公司存在暫停上市或退市風險。公司同時表示,無法按照預定時間披露2018年半年度報告及對后續重大風險事項進行了說明。ST長生最終是否會被深圳證券交易所終止上市目前暫無定論,但是其蘊含的風險是有目共睹的。 數據顯示,今年以來,烯碳退、退市吉恩、退市昆機和深基地B等4只股票已完成退市,其中前三只的終止上市原因都是連續3年虧損,且均在7月密集退市。 而在8月末,A股市場又有2017年5月因最近3年連續虧損而被暫停上市的攀鋼釩鈦恢復上市和開展重大資產重組后的重藥控股恢復上市。 股票退市、被提示風險和恢復上市往往會伴隨著股價的劇烈變動,對于部分投資者來說,不了解相關規定也就無法作出持有還是拋售的理性抉擇,甚至也有投資者盲目跟風一搏而導致損失慘重。《每日經濟新聞》記者下面將簡要介紹證監會和滬深交易所對ST、*ST和退市流程的相關規定,大家一起來學習一下。 披星戴帽股票操作需謹慎 證監會于1998年3月16日頒布了《關于上市公司財務狀況異常期間的股票特別處理方式的通知》,要求證券交易所對狀況異常的上市公司股票交易實行特別處理。要求包括,特別處理股票的報價日漲跌幅限制為5%,證券交易所應在發給會員的行情數據中,于特別處理的股票前加“ST”標記。 根據滬深交易所最新修訂的《證券交易所股票上市規則》,上市公司出現財務狀況異常情況或者其他異常情況,導致其股票存在被終止上市的風險,或者投資者難以判斷公司前景,投資者權益可能受到損害的,會對該公司股票實施風險警示。 風險警示分為兩種:存在終止上市風險的風險警示(以下簡稱退市風險警示)和其他風險警示。上市公司股票被實施退市風險警示的,在公司股票簡稱前冠以“*ST”字樣;被實施其他風險警示的,在公司股票簡稱前冠以“ST”字樣。也就是說,ST是特別處理,*ST是終止上市風險特別處理,被實施退市風險警示和其他風險警示的觸發條件以及可申請撤銷風險警示的條件也有嚴格規定。 但是退市也并不是一蹴而就的,因此就會有投資者在這個過程中火中取栗。以在深交所上市的主板、中小板因連續虧損而退市的流程為例,分為:條件觸發、退市風險警示、暫停上市決定、暫停上市、終止上市決定、退市整理期和摘牌退市這幾個步驟。若是在深交所上市的創業板因重大違法行為而退市,流程分為:條件觸發、交易30日、暫停上市決定、暫停上市、終止上市決定、退市整理期和摘牌退市。雖然股票在被暫停上市后還是有恢復上市的可能,但是往往已元氣大傷,股價表現并不盡如人意。 8月31日,證監會答復政協《關于推動“僵尸企業”依法退市的提案》時表示,下一步,證監會將繼續從保護中小投資者利益的角度出發,不斷完善退市制度,指導交易所進一步嚴格落實退市決策主體責任,堅決維護退市制度的嚴肅性和權威性,推動形成“有進有出”的市場化、常態化退市工作機制,持續提高市場有效性,不斷防范化解風險,切實服務實體經濟,維護資本市場穩定健康發展。 總之,投資被實施風險警示的股票風險普遍大于正常上市的股票,普通投資者一定要注意分析股票的基本面及所面臨的情況,切忌跟風炒作。[詳情]

復星醫藥子公司被舉報進展:國家藥監局責成重慶食藥監局開展徹查 已派出督察組 |新京報財訊 新京報快訊(記者李云琦)8月31日,國家藥品監督管理局官網發布藥品監管要聞稱,針對網絡反映舉報重慶醫藥工業研究院有限責任公司(重慶醫工院)情況,國家藥監局已責成重慶市食藥監局開展徹查,盡快查清核實。“如發現違法違規行為,依法嚴肅查處。調查結果及時向社會公開。 此前的8月24日,重慶市食藥監局的官網上的公開郵箱中,更新出一封舉報信。該舉報信標題為《重慶醫藥工業研究院制藥公司嚴重違反藥品管理法》,舉報人自稱“我們是重慶醫藥工業研究院有限責任公司的員工”,“以上反映的我院嚴重違反國家藥品管理法規的情況是我們親身經歷和了解到的事實”。 在舉報信中,舉報人直言重慶醫工院存在“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書”、曾“集中力量做重慶市食藥監局工作,又請吃飯,又送紅包”等行為。 8月30日晚間,復星醫藥發布公告對舉報信內容做出回應稱,重慶食藥監局已就舉報信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。 8月31日,新京報記者致電復星醫藥證券部,工作人員回應稱,“我們內部看是沒有任何問題”。[詳情]

復星醫藥子公司被曝造假!各方緊急回應。然后,之前的舉報信不見了 來源: 金融投資報 距離ST長生出事僅一個月,復星醫藥也惹上事情了。 8月24日,重慶市食品藥品監管局公開信箱公布了一條醫藥研究公司內部員工舉報公司造假的信息。 該舉報人聲稱,其本人為重慶醫藥工業研究院有限責任公司的員工,最近看了長生生物的報道后認為,“其所在公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及。” 值得注意的是,這位舉報人所在的重慶醫藥工業研究院系復星醫藥二級子公司。 受此消息影響,復星醫藥AH股集體暴跌,A股集合競價大幅低開近8%,H股開盤大跌超7%。截止收盤時,A股下跌近7%,收于29.22元;H股下跌近5%,收于31.7元。 1 復星醫藥子公司被曝造假和賄賂 在這份舉報信中,舉報人直言目前重慶醫工院生產質量管理十分混亂,領導無視藥品生產管理法規,帶頭弄虛作假。 存在“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書”等行為。 并具體列出在2016年5月、2017年11月,先后被美國FDA警告和給予最差評價的結果(OVI),而以上結果可以查閱美國FDA出具的483文件。 不僅如此,目前院里領導正在組織公關部,就阿力哌唑、培美曲塞二鈉等兩個產品重大工藝改變,集中力量做重慶市藥監局的工作,又請吃飯,又送紅包,使其得到重慶市藥監局的批準備案。據說重慶市藥監局安監處負責人已經答應辦理! 值得注意的是,對于FDA的警告信,的確是在其官網上公開可查,且復星醫藥曾在2017年3月也對此事給予了披露,當時復星醫藥稱將進行有效整改,并積極與FDA溝通,爭取盡快解除警示。由此來看,FDA查出的問題真實可信,復星醫藥子公司的確存在編造生產記錄、檢驗記錄等嚴重違反藥品管理法規的情況。 2 各方回應,但舉報信卻不見了! 在此事發生之后,復星醫藥立馬在30日晚間披露了關于媒體報道說明的公告。 復星醫藥在公告中表示,2017年11月,FDA針對醫工院制藥(長壽區新場地)的質量體系進行批準前檢查。檢查后對于原料藥阿立哌唑提出一條483缺陷,該缺陷主要針對阿力哌唑檢測時所產生的無效OOS(偏差調查)不充分。目前,醫工院制藥已經在FDA的規范指引下展開整改。 金妹兒查詢“FDA的無效OOS檢查”發現,這是FDA提出用于評估藥品制造設施質量量度的三個指標之一,是FDA檢查的重點。 無效的OOS 率=設施確認無效的成品OOS結果數÷OOS結果總數除以同一段時間設施進行的檢驗總數。 是作為衡量實驗室操作的穩定可靠性的指標,無效的OOS率越高,說明實驗室操作的穩定性越差。 既然之前FDA已經對復星醫藥子公司作出警告,并給予最差評價。那么,則意味著復星醫藥子公司所生產制造的藥品很可能和長生生物一樣是劣質藥。 而生產和包裝記錄的完整性不足、生產工藝不達標等都是造成無效OOS的原因。 歐盟表示,如果有多個無效OOS,也將導致GMP檢查不合格。這也剛好與上述舉報信中,“領導帶領員工大量編造生產記錄、檢驗記錄”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書”等表述相對應。 此外,此次涉事的藥品為精神病藥。有網友戲稱,反正都是精神病人,治不好也無可厚非。 “上次長生生物的事件里就涉及重慶藥監局,所以這次復星醫藥子公司出事也不奇怪了!” 而根據上述舉報人稱,重慶醫工院生產主要產品(原料藥)幾乎同時供應國內外市場,那么在2016年、2017年國內的精神病人很可能已經使用了復星醫藥子公司生產的劣質藥品。 此外,復星醫藥還在公告中稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。 8月31日早上,重慶市食品藥品監管局公開信箱也更新了調查進展情況并公開回復舉報人信息。 我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前我們一直未能聯系上實際舉報人。 不過蹊蹺的是,31日中午,金妹兒在重慶市藥監局官網上,卻發現該封舉報信不見了!其他媒體也表示,在點開此前保存的該郵件地址后,出現了“對不起,未找到該郵件”的彈窗。 而對于此次重慶藥監局的飛行檢查結果以及后續事件的發展,金妹兒將持續關注。[詳情]
老板們要小心了 現在流行員工舉報 【顧盼生思】 政府管理部門不應只在收到舉報后痛下殺手,而要注重長效管理。 顧惠忠 長生生物員工舉報捅出了疫苗事件,上周又有復星醫藥旗下企業員工向重慶藥監局舉報,說公司存在編造生產記錄、騙取GMP證書等嚴重違規問題。而據我們所知,還有別的醫藥上市公司員工舉報“東家”,只是舉報的方向不同。粗看起來,現在似乎很流行員工舉報,而且,對準的都是企業的“生死穴”。 長生事件處理一批省部級官員,給地方首腦及分管領導、國家主管部門極大的震撼,加大了對企業的監管力度。前幾天,筆者走訪疫苗企業時聽說當地政府在長生事件后隔三岔五就到公司來檢查一次,還在考慮派駐廠監督員。所以,現在只要有員工舉報企業,主管部門和地方政府一定會嚴查,而不會過多地考慮是否影響地方經濟。復星醫藥子公司員工舉報發生后,國家藥監局立馬派督查組監督重慶藥監局的調查,也足以說明現今政府對企業重大違法違規行為的零容忍。 證券市場對公司出現的風險苗頭更是零容忍,機構們一有風吹草動“撒腿”就跑,直接讓股價“死給”老板們看。 所以,老板們對員工舉報現象要高度重視。 員工舉報“東家”的直接動因往往是認為個人利益受損或未得到保障,長生生物事件就是因為有老員工因為加班費不公而舉報。所以,老板們要善待員工,首先的一條是要給員工合理的報酬,要給員工好的激勵。前段時間筆者訪談了安科生物董事長宋禮華。2009年上市以來,安科生物每年的業績持續保持兩位數以上的增長。在說到有何秘訣時,宋禮華告訴筆者,重要的一點是公司的體制。安科生物經過幾次員工激勵,把公司打造成全體骨干持股的模式。現在的安科生物不僅僅是一家公眾公司,更是一家員工持股的上市公司,2000多員工持有公司股份。宋禮華說,這是他們的核心保障。企業在良性發展的過程當中,股票對于每一個員工、每一個骨干來說是一個“定心丸”,大家更容易捆綁在一起。 現今宏觀趨勢嚴峻,很多企業在開源節流,而“節流”如果操作不當容易引起員工不滿,極易引來舉報。 當然了,如果企業自身過硬就不怕員工舉報。所以,企業在做好員工激勵的同時,更要在經營上合法守規。老板們既要把握好企業整體的合法經營,也要通過技術手段等促使員工合法合規操作,甚至防范個別員工故意搗亂、先搗亂再舉報。如藥品生產企業要通過在每個流程、每臺設備上加裝不可更改數據的監控設施來嚴格嚴密管控整個生產流程,防范因為員工的不當操作而給企業帶來滅頂之災。這可能會增加企業經營成本,但與生存風險相比,這個投入是必要的。何況以設備的智能化減少了人的使用,除了一次性投入較大外,真正的成本并不一定高。 而政府管理部門也不應只在收到舉報后痛下殺手,而要注重長效管理。如前面說的藥品生產,藥監部門的監控系統應該盡可能地與企業的設備改進匹配,要出臺相應的指引或規劃,不要在企業設備改造后再搞一套系統,人為地增加企業成本。 (作者系證券時報記者)[詳情]
員工自曝子公司“五宗罪” 復星醫藥市值蒸發超50億元 上周五復星醫藥遭遇“黑天鵝”,當天A股和H股開盤均大跌,此前子公司被員工舉報編造生產記錄,騙取GMP證書。當天, 復星醫藥收報29.20元,跌幅6.89%,市值蒸發超50億元; 復星醫藥H股收報31.70元,跌幅4.80%。復星醫藥回應“重慶食藥監局對其子公司展開調查”稱,內部看沒有任何問題。 員工舉報:重慶醫工院5大違規 此前, 復星醫藥控股子公司重慶醫藥工業研究院有限責任公司(簡稱“重慶醫工院”)被曝出違規生產藥品,存在編造生產記錄、檢驗記錄等現象。據重慶市食品藥品監管局官網公開信箱公布的一封來信顯示,重慶醫工院員工舉報主要集中在以下5點內容:一是生產質量管理混亂,連續兩年被美國FDA現場查出違規得到差評;二是幾乎所有生產都沒有根據批準的工藝生產;三是騙取藥品GMP證書,在申請證書過程中,編造生產和檢驗記錄,蒙騙過關。四是主要供應上海中西藥業的產品阿力哌唑沒有根據國家批準的工藝生產,嚴重違反藥品管理法規;五是集中力量忙公關,從而得到相關批準備案。 重慶市食品藥品監管局回復稱,該局高度重視,已啟動對舉報人投訴舉報的企業開展相關調查工作,并派出檢查組進駐企業,如發現企業存在舉報內容相關的違法違規生產行為,將依法查處。 公司自辯:尚待結論性意見 對于舉報信件, 復星醫藥 8月30日晚間披露說明公告:針對FDA出具警告信、提出的整改,已對時任主要領導及相關負責人進行了嚴肅處理調整,并積極推進相關整改工作,力爭盡快通過現場檢查;據自查,現有產品均據已批準的工藝進行生產,對于生產工藝的調整均經相關藥監部門批準或備案;重慶食藥監局已就舉報內容開展調查,并已對重慶醫工院進行了飛行檢查,檢查結果尚待結論性意見等。 投資者更關心“藥去哪兒” 就在上周初, 復星醫藥公布2018年中報:實現收入117.62億元人民幣, 同比增長42.17%。盡管如此,市場用戶和投資者關心的則是這些“問題藥品”究竟流向了何方?據復星醫藥說明公告披露,重慶醫工院及其控股子公司醫工院制藥主要產品全球范圍均有銷售,但并未披露具體流向的企業。受此影響,上周五多家上市醫藥公司股價受到牽連,其中重藥控股暴跌9.48%,上海醫藥收跌2.21%,恒瑞醫藥收跌2.71%。 揚子晚報/揚眼記者 范曉林[詳情]
復星醫藥二級子公司遭舉報 重慶食藥監局稱一直未能聯系上舉報人 每經記者 陳晴 每經編輯 張海妮 長生疫苗案后,醫藥領域又出現員工舉報企業造假。8月30日,每日經濟新聞獨家報道,重慶醫藥工業研究院有限責任公司的員工,通過重慶市食品藥品監管局網站,舉報公司編造生產記錄、檢驗記錄,騙取藥品GMP證書等情況。 而重慶醫藥工業研究院有限責任公司是復星醫藥的子公司。該事件一出,引起各方關注。國家藥監局迅速派出督查組,對調查工作進行督查。復星醫藥也緊急發布澄清公告。那么,被舉報的重慶醫藥工業研究院有限責任公司的情況究竟怎樣?剛剛過去的這個周末,我們的記者進行了實地探訪。 復星醫藥(600196,SH)二級子公司重慶醫藥工業研究院有限責任公司(以下簡稱重慶醫工院)遭舉報事件有了新進展。8月30日深夜和8月31日早間,復星醫藥和重慶市食品藥品監管局(以下簡稱重慶食藥監局)相繼發布最新進展或說明。 重慶食藥監局開展調查 此次重慶食藥監局官網發布的舉報信,來自重慶醫工院內部員工,其稱“我院制藥公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及”。 舉報信提到了多方面的舉報內容,包括:重慶醫工院存在“幾乎所有生產工藝都沒有根據批準的工藝生產”“領導帶領員工大量編造生產記錄、檢驗記錄”“在2016年5月美國FDA現場檢查后,得到了警示信!”“2017年11月美國FDA再次現場檢查,又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI)”“欺騙上級藥品監督管理部門,騙取藥品GMP證書”“主要供應上海中西藥業的產品——阿力哌唑,工藝作了重大改變”“集中力量做重慶市藥監局的工作,又請吃飯,又送紅包”等行為。 對于上述舉報事件,8月31日早間,重慶食藥監局公開信箱更新了調查進展:我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前我們一直未能聯系上實際舉報人。 重慶食藥監局稱:“熱忱歡迎舉報人或知情人士負責任地向我局提供全面、客觀、詳實的證據,我們一定認真核查,依法依規嚴肅處理。” 復星醫藥深夜發布事件說明 舉報事件發生后,8月30日深夜,復星醫藥也發布了“關于媒體報道的有關情況”的說明。根據公告,重慶醫工院及其制藥公司重慶醫工院制藥有限責任公司(以下簡稱醫工院制藥)主要從事仿制藥原料藥和中間體的研發、生產和銷售,主要客戶為歐美及中國的制劑企業。其中重慶醫工院是復星醫藥的二級控股子公司。 《每日經濟新聞》記者注意到,舉報信中的部分舉報情況得到了復星醫藥的確認,例如,“在2016年5月美國FDA現場檢查后,得到了警示信!”復星醫藥稱公司曾于2017年3月發布相關公告。 不過,針對舉報信中提到的“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”,復星醫藥稱,根據醫工院制藥自查,現有產品均根據已批準的工藝進行生產。在生產過程中,對于生產工藝的調整均經相關藥監部門批準或備案。 針對舉報信中提到的“主要供應上海中西藥業的產品——阿力哌唑,工藝作了重大改變”,復星醫藥回應稱,根據經營的需要,重慶醫工院于2016年向醫工院制藥轉移了阿立哌唑、培美曲塞二鈉產品批件,于2018年轉移了蔗糖鐵產品批件,并已通過藥監部門的現場檢查和批準;醫工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報,2018年提供給上海中西三維藥業有限公司的產品僅作為其制劑研究之用。 復星醫藥還稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。[詳情]
國家藥監局:已派督查組介入重慶醫工院被舉報事件 每經記者 陳晴 每經編輯 文多 復星醫藥子公司重慶醫藥工業研究院有限責任公司(以下簡稱重慶醫工院)被內部員工舉報事件持續發酵。8月31日晚間,《每日經濟新聞》記者注意到,國家藥品監督管理局已介入。 國家藥品監督管理局官網8月31日發文稱,針對網絡反映舉報重慶醫藥工業研究院有限責任公司的情況,國家藥品監督管理局已責成重慶市食品藥品監督管理局開展徹查,盡快查清核實。如發現違法違規行為,依法嚴肅查處。調查結果及時向社會公開。國家藥監局已派出督查組,對調查工作進行督查。 重慶食藥監局官網公布的舉報信顯示,此次舉報來自重慶醫工院內部員工,舉報信中稱:“我院制藥公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及”。 舉報信中還舉例稱:重慶醫工院“幾乎所有生產工藝都沒有根據批準的工藝生產”“領導帶領員工大量編造生產記錄、檢驗記錄”,還稱“2017年11月美國FDA再次現場檢查,又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI)”“欺騙上級藥品監督管理部門,騙取藥品GMP證書”“ 集中力量做重慶市藥監局的工作,又請吃飯,又送紅包”。 針對此次舉報事件,8月31日早間,重慶食藥監局公開信箱更新的調查進展顯示:該局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的該局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前該局一直未能聯系上實際舉報人。 [詳情]
復星醫藥董事長:公司產品經得起查,若有問題將嚴肅整改完善 每經記者 徐杰 實習記者 張瀟尹 每經編輯 張海妮 日前,復星醫藥(600196,SH)旗下重慶醫藥工業研究院有限責任公司(以下簡稱重慶醫工院)遭舉報:編造生產記錄、騙取藥品GMP(生產質量管理規范)證書、存在嚴重違反國家藥品生產管理法規行為。 8月31日午間,復星醫藥就此召開媒體澄清會。會上,復星醫藥董事長陳啟宇通報稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。同時,復星醫藥進行了內部自查,目前已確認現有產品均根據已批準的工藝進行生產,對于生產工藝的調整均經相關藥監部門批準或備案,復星醫藥將實時掌握舉報和檢查的動態情況。 據陳啟宇介紹,重慶醫工院及其制藥公司主要從事仿制藥原料藥和中間體的研發、生產和銷售,復星醫藥持有其56%股份。2017年度,重慶醫工院實現營業收入7780萬元,占復星醫藥2017年度營業收入的0.42%,其年度凈虧損超過3000萬元。近兩年受內外部因素影響,重慶醫工院的經營仍處于虧損和投入的階段。 針對舉報信中“在2016年5月美國FDA現場檢查后,重慶醫工院得到了警示信”的內容,陳啟宇回應稱,公司針對該警示信已于2017年3月2日刊發了相關公告,并對時任的總經理等相關負責人給予嚴肅處理調整。彼時,重慶醫工院已形成新的領導班子,并積極推進相關整改工作。此外,陳啟宇進一步表示:“當時正值重慶醫工院新建原料藥基地和工廠搬遷,美國FDA現場檢查的是原來舊的生產設施,目前公司已經完全放棄(對)這些設施的使用。” 此外,針對8月31日上午重慶市食藥監局官網上的相關舉報信“失蹤”問題,陳啟宇回應稱,該舉報信并非“消失”,而是由于后續情況有所更新,其在會上通報了重慶市食藥監局的最新調查進展:目前重慶市食藥監局已組織主要由國家藥品GMP檢查員組成的調查組,對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的該局監管人員接受吃請、收受紅包進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前尚未聯系上實際舉報人。 陳啟宇表示復星醫藥將始終堅持以創新為導向,守住合規經營的底線。公司在多年前已建立內部飛行檢查制度,掌握第一手的生產經營情況,同時接受來自政府部門、國內外監管機構、客戶等多方位的檢查。他進一步表示:“因此‘經得起查’是我們生產經營的基本工作,若在檢查中發現問題,我們會嚴肅地加以整改和完善。” [詳情]
每經記者實探重慶醫工院:提及被舉報之事 有員工快步離開 每經記者 王琳 陳晴 每經編輯 文多 復星醫藥(600196,SH)旗下二級子公司被舉報事件引起市場震動。8月31日,復星醫藥3家相關上市公司的股價均出現不同程度下跌,其中復星醫藥股價下跌6.89%。 處在旋渦中心的主角,即復星醫藥旗下的重慶醫藥工業研究院(以下簡稱重慶醫工院)當前情況如何?8月31日,《每日經濟新聞》記者進行了實地探訪。 員工稱“事情還在調查” 據重慶醫工院官網資料,重慶醫工院成立于1950年,是當時西南地區唯一的主要從事化學藥物研究開發的專業研究開發的事業單位。2001年,作為重慶市首批科研院所轉制的單位,由上海復星醫藥產業發展有限公司與重慶醫藥(集團)股份有限公司合資組建成立重慶醫藥工業研究院有限責任公司。 根據復星醫藥8月30日晚間公告,截至公告日,重慶醫工院的注冊資本為5500萬元,其制藥公司即重慶醫工院制藥有限責任公司(以下簡稱醫工院制藥)的注冊資本為1.35億元。 8月31日上午,《每日經濟新聞》記者來到位于重慶市南岸區涂山路565號的重慶醫藥工業研究院有限責任公司。 一位自稱是藥物分析部門的員工一開始向記者表示,不知道公司被舉報的事情,但在后續聊天中該員工又表示,聽說(舉報)是虛假的,而記者詢問這個是否為公司領導的說法時,該員工僅表示:“這個事情還在調查,等結果,因為大家都說不準,只有等藥監局的過來查一下,因為生產都在長壽區,所以檢查也在長壽。” 上述員工還表示,自己不了解公司的業績,但是自己的收入一般,不好也不差。此外,記者詢問的另外兩名重慶醫工院員工中,一人表示自己不知道公司被舉報的事,另一人聽到《每日經濟新聞》記者說起舉報之事,立即快步揮手離開。 重藥控股:未參與被舉報公司生產經營 針對此次舉報事件,8月31日早間重慶食藥監局公開信箱更新的調查進展顯示:主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;發現其所留信息不是舉報人真實信息,目前一直未能聯系上實際舉報人。 調查結果未出,相關事件已引起了投資者的關注。繼復星醫藥通過公告和官方微信公眾號對事件進行說明以后,8月31日下午,有投資者在互動平臺上就此向重藥控股提出疑問。 對此,重藥控股回復稱,公司控股子公司重慶醫藥集團持有復星醫藥子公司重慶醫工院43.11%股權,僅作為財務投資,并未參與醫工院、醫工院制藥的生產經營。 被波及的不止上述兩家上市公司。舉報信稱:“主要供應上海中西藥業的產品——阿力(立)哌唑,工藝作了重大改變,不但沒有根據國家批準的工藝生產,而且經2017年11月美國FDA再次現場檢查發現了嚴重違反藥品管理法規的行為。” 《每日經濟新聞》記者查詢發現,阿立哌唑是一種主治精神分裂癥的藥物,而中西藥業曾經為A股上市公司,至2010年被上海醫藥(601607,SH)換股吸收,正式退市。 根據上海醫藥2014年和2015年年報,阿立哌唑的銷售收入分別為12629萬元和13622萬元。而此后,上海醫藥的年報中再未出現該藥名。 8月31日晚,國家藥品監督管理局官網也發文表示介入此事,并提到國家藥監局已派出督查組,對調查工作進行督查。 [詳情]
復星醫藥突遭利空盤中跌停 投資者該如何面對黑天鵝 8月30日,復星醫藥(港股02196)(600196,SH)子公司被其員工舉報至重慶市食品藥品監督局的消息被廣泛傳播。雖事件尚未有正式調查結果,復興醫藥也密集發聲以證清白,但是,復興醫藥8月31日股價應聲下跌,A股開盤觸及跌停板,收盤跌6.89%,在醫藥制造板塊跌幅榜居前。《每日經濟新聞》記者注意到,復興醫藥投資者有如驚弓之鳥的表現跟今年A股“黑天鵝”事件不無關系。 今年,市場上對退市、ST等話題的討論尤為常見,A股市場先后有四家公司退市,金亞科技因欺詐發行已被深交所啟動強制退市機制,股票存在被暫停及終止上市的風險,ST長生發出提示稱公司存暫停上市或退市風險。 出現退市風險或是被實施特別風險警示的股票股價常常會遭遇數個跌停,偶爾也出現強勢上漲的情況。對于不太了解相關流程和規定的投資者來說,在做堅定持有還是盡早逃離的選擇前搖擺不定,甚至還有投資者火中取栗后損失慘重。在A股市場中面對這類股票如何理性投資呢?《每日經濟新聞》記者下面就和大家一起學習一下。 今年以來4只票完成退市 今年A股市場上關于退市、ST等話題時有出現,這些股票股價的劇烈波動總不免引起熱議。 6月底,繼欣泰電氣后,A股第二例欺詐發行強制退市也在今年產生,那就是利用虛增收入利潤等手法騙取IPO核準的金亞科技。 而長生生物的疫苗事件可謂A股7月的“黑天鵝”。ST長生8月30日漲停、8月31日跌停的劇烈變化引起了市場的極大關注。ST長生8月30日晚發布公告表示,根據國務院會議指示,將沒收公司全資子公司長春長生生物科技有限責任公司所有違法所得并處最高罰款,巨額罰款可能會導致公司存在暫停上市或退市風險。公司同時表示,無法按照預定時間披露2018年半年度報告及對后續重大風險事項進行了說明。ST長生最終是否會被深圳證券交易所終止上市目前暫無定論,但是其蘊含的風險是有目共睹的。 數據顯示,今年以來,烯碳退、退市吉恩、退市昆機和深基地B等4只股票已完成退市,其中前三只的終止上市原因都是連續3年虧損,且均在7月密集退市。 而在8月末,A股市場又有2017年5月因最近3年連續虧損而被暫停上市的攀鋼釩鈦恢復上市和開展重大資產重組后的重藥控股恢復上市。 股票退市、被提示風險和恢復上市往往會伴隨著股價的劇烈變動,對于部分投資者來說,不了解相關規定也就無法作出持有還是拋售的理性抉擇,甚至也有投資者盲目跟風一搏而導致損失慘重。《每日經濟新聞》記者下面將簡要介紹證監會和滬深交易所對ST、*ST和退市流程的相關規定,大家一起來學習一下。 披星戴帽股票操作需謹慎 證監會于1998年3月16日頒布了《關于上市公司財務狀況異常期間的股票特別處理方式的通知》,要求證券交易所對狀況異常的上市公司股票交易實行特別處理。要求包括,特別處理股票的報價日漲跌幅限制為5%,證券交易所應在發給會員的行情數據中,于特別處理的股票前加“ST”標記。 根據滬深交易所最新修訂的《證券交易所股票上市規則》,上市公司出現財務狀況異常情況或者其他異常情況,導致其股票存在被終止上市的風險,或者投資者難以判斷公司前景,投資者權益可能受到損害的,會對該公司股票實施風險警示。 風險警示分為兩種:存在終止上市風險的風險警示(以下簡稱退市風險警示)和其他風險警示。上市公司股票被實施退市風險警示的,在公司股票簡稱前冠以“*ST”字樣;被實施其他風險警示的,在公司股票簡稱前冠以“ST”字樣。也就是說,ST是特別處理,*ST是終止上市風險特別處理,被實施退市風險警示和其他風險警示的觸發條件以及可申請撤銷風險警示的條件也有嚴格規定。 但是退市也并不是一蹴而就的,因此就會有投資者在這個過程中火中取栗。以在深交所上市的主板、中小板因連續虧損而退市的流程為例,分為:條件觸發、退市風險警示、暫停上市決定、暫停上市、終止上市決定、退市整理期和摘牌退市這幾個步驟。若是在深交所上市的創業板因重大違法行為而退市,流程分為:條件觸發、交易30日、暫停上市決定、暫停上市、終止上市決定、退市整理期和摘牌退市。雖然股票在被暫停上市后還是有恢復上市的可能,但是往往已元氣大傷,股價表現并不盡如人意。 8月31日,證監會答復政協《關于推動“僵尸企業”依法退市的提案》時表示,下一步,證監會將繼續從保護中小投資者利益的角度出發,不斷完善退市制度,指導交易所進一步嚴格落實退市決策主體責任,堅決維護退市制度的嚴肅性和權威性,推動形成“有進有出”的市場化、常態化退市工作機制,持續提高市場有效性,不斷防范化解風險,切實服務實體經濟,維護資本市場穩定健康發展。 總之,投資被實施風險警示的股票風險普遍大于正常上市的股票,普通投資者一定要注意分析股票的基本面及所面臨的情況,切忌跟風炒作。[詳情]
復星醫藥子公司被舉報進展:國家藥監局責成重慶食藥監局開展徹查 已派出督察組 |新京報財訊 新京報快訊(記者李云琦)8月31日,國家藥品監督管理局官網發布藥品監管要聞稱,針對網絡反映舉報重慶醫藥工業研究院有限責任公司(重慶醫工院)情況,國家藥監局已責成重慶市食藥監局開展徹查,盡快查清核實。“如發現違法違規行為,依法嚴肅查處。調查結果及時向社會公開。 此前的8月24日,重慶市食藥監局的官網上的公開郵箱中,更新出一封舉報信。該舉報信標題為《重慶醫藥工業研究院制藥公司嚴重違反藥品管理法》,舉報人自稱“我們是重慶醫藥工業研究院有限責任公司的員工”,“以上反映的我院嚴重違反國家藥品管理法規的情況是我們親身經歷和了解到的事實”。 在舉報信中,舉報人直言重慶醫工院存在“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書”、曾“集中力量做重慶市食藥監局工作,又請吃飯,又送紅包”等行為。 8月30日晚間,復星醫藥發布公告對舉報信內容做出回應稱,重慶食藥監局已就舉報信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。 8月31日,新京報記者致電復星醫藥證券部,工作人員回應稱,“我們內部看是沒有任何問題”。[詳情]
復星醫藥子公司被曝造假!各方緊急回應。然后,之前的舉報信不見了 來源: 金融投資報 距離ST長生出事僅一個月,復星醫藥也惹上事情了。 8月24日,重慶市食品藥品監管局公開信箱公布了一條醫藥研究公司內部員工舉報公司造假的信息。 該舉報人聲稱,其本人為重慶醫藥工業研究院有限責任公司的員工,最近看了長生生物的報道后認為,“其所在公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及。” 值得注意的是,這位舉報人所在的重慶醫藥工業研究院系復星醫藥二級子公司。 受此消息影響,復星醫藥AH股集體暴跌,A股集合競價大幅低開近8%,H股開盤大跌超7%。截止收盤時,A股下跌近7%,收于29.22元;H股下跌近5%,收于31.7元。 1 復星醫藥子公司被曝造假和賄賂 在這份舉報信中,舉報人直言目前重慶醫工院生產質量管理十分混亂,領導無視藥品生產管理法規,帶頭弄虛作假。 存在“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書”等行為。 并具體列出在2016年5月、2017年11月,先后被美國FDA警告和給予最差評價的結果(OVI),而以上結果可以查閱美國FDA出具的483文件。 不僅如此,目前院里領導正在組織公關部,就阿力哌唑、培美曲塞二鈉等兩個產品重大工藝改變,集中力量做重慶市藥監局的工作,又請吃飯,又送紅包,使其得到重慶市藥監局的批準備案。據說重慶市藥監局安監處負責人已經答應辦理! 值得注意的是,對于FDA的警告信,的確是在其官網上公開可查,且復星醫藥曾在2017年3月也對此事給予了披露,當時復星醫藥稱將進行有效整改,并積極與FDA溝通,爭取盡快解除警示。由此來看,FDA查出的問題真實可信,復星醫藥子公司的確存在編造生產記錄、檢驗記錄等嚴重違反藥品管理法規的情況。 2 各方回應,但舉報信卻不見了! 在此事發生之后,復星醫藥立馬在30日晚間披露了關于媒體報道說明的公告。 復星醫藥在公告中表示,2017年11月,FDA針對醫工院制藥(長壽區新場地)的質量體系進行批準前檢查。檢查后對于原料藥阿立哌唑提出一條483缺陷,該缺陷主要針對阿力哌唑檢測時所產生的無效OOS(偏差調查)不充分。目前,醫工院制藥已經在FDA的規范指引下展開整改。 金妹兒查詢“FDA的無效OOS檢查”發現,這是FDA提出用于評估藥品制造設施質量量度的三個指標之一,是FDA檢查的重點。 無效的OOS 率=設施確認無效的成品OOS結果數÷OOS結果總數除以同一段時間設施進行的檢驗總數。 是作為衡量實驗室操作的穩定可靠性的指標,無效的OOS率越高,說明實驗室操作的穩定性越差。 既然之前FDA已經對復星醫藥子公司作出警告,并給予最差評價。那么,則意味著復星醫藥子公司所生產制造的藥品很可能和長生生物一樣是劣質藥。 而生產和包裝記錄的完整性不足、生產工藝不達標等都是造成無效OOS的原因。 歐盟表示,如果有多個無效OOS,也將導致GMP檢查不合格。這也剛好與上述舉報信中,“領導帶領員工大量編造生產記錄、檢驗記錄”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書”等表述相對應。 此外,此次涉事的藥品為精神病藥。有網友戲稱,反正都是精神病人,治不好也無可厚非。 “上次長生生物的事件里就涉及重慶藥監局,所以這次復星醫藥子公司出事也不奇怪了!” 而根據上述舉報人稱,重慶醫工院生產主要產品(原料藥)幾乎同時供應國內外市場,那么在2016年、2017年國內的精神病人很可能已經使用了復星醫藥子公司生產的劣質藥品。 此外,復星醫藥還在公告中稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。 8月31日早上,重慶市食品藥品監管局公開信箱也更新了調查進展情況并公開回復舉報人信息。 我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前我們一直未能聯系上實際舉報人。 不過蹊蹺的是,31日中午,金妹兒在重慶市藥監局官網上,卻發現該封舉報信不見了!其他媒體也表示,在點開此前保存的該郵件地址后,出現了“對不起,未找到該郵件”的彈窗。 而對于此次重慶藥監局的飛行檢查結果以及后續事件的發展,金妹兒將持續關注。[詳情]
復星醫藥陷“舉報門”股價雙殺,銷售費用為何連年增長? 8月31日,復星醫藥(600196.SH,02196.HK)A股、H股雙雙跳空低開,其中A股一度觸及跌停板。截至發稿,A股和H股均跌逾6%。 繼ST長生之后,復星醫藥又陷“舉報門”。近日復星醫藥子公司遭內部員工舉報生產質量管理混亂、編造生產記錄和檢驗記錄、騙取藥品GMP證書、相關產品嚴重違反藥品管理法規的行為等情況。 對此,8月30日晚間,復星醫藥對上述問題進行了澄清。8月31日早晨,重慶市食品藥品監管局(下沉“重慶食藥監”)公開信箱更新調查進展情況稱,正對舉報的問題開展深入調查。不過,復星醫藥相關負責人士稱,去年涉事子公司營收占復星醫藥營收不到1%,目前上市公司經營方面不受影響。 值得注意的是,復星醫藥的銷售費用呈現出逐年增長的態勢,其中今年上半年銷售費用達到38億元,占營業收入的32%,對于銷售費用連年增長的原因,復星醫藥解釋成為,該公司核心產品銷售增長以及市場開拓深入所致。那么這些高額銷售費用具體是流向了何方呢? 子公司被舉報 近日,重慶食藥監官網公開信箱一封舉報信顯示,自稱為重慶醫藥工業研究院有限責任公司(下稱“重慶醫工院”)的員工舉報該公司生產質量管理混亂,多次被FDA(美國食品藥品監督管理局)檢查出嚴重違反藥品管理法規的情況;“領導帶領員工大量編造生產記錄、檢驗記錄”;“欺騙上級藥品監督管理部門,騙取藥品GMP證書”;公關重慶市藥監局爭取批準備案等行為。 隨即,重慶食藥監回復稱,已啟動對所投訴舉報的企業開展相關調查工作,已派出檢查組進駐企業。 據了解,重慶醫工院及其制藥公司重慶醫工院制藥有限責任公司(下稱“醫工院制藥”)主要從事仿制藥原料藥和中間體的研發、生產和銷售,主要客戶為歐美及中國的制劑企業。 2017年度,重慶醫工院(合并口徑)實現營業收入7780萬元,實現歸屬于母公司凈利潤-3461萬元。其中,境外銷售收入占比約26%。其中,適用于精神分裂癥的原料藥阿立哌唑2017年在中國境內銷售收入為164萬元,為重慶醫工院及醫工院制藥四個主要產品中收入最少的一款產品。 從股權結構來看,復星醫藥全資子公司上海福星醫藥產業發展有限公司持有重慶醫工院56.89%股份,重慶醫藥(集團)股份有限公司持有剩余的43.11%。重慶醫工院持有醫工院制藥70.37%的股份。 針對上述舉報事件,復星醫藥8月30日晚間發布澄清公告稱,醫工院制藥已經在 FDA 的規范 指引下展開整改,力爭盡快通過FDA現場檢查;根據醫工院制藥自查,現有產品均根據已批準的工藝進行生產。在生產過程中,對于生產工藝的調整均經相關藥監部門批準或備案醫;工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報。 8月31日早晨,重慶食藥監公開信箱更新調查進展情況稱,該局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的該局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前一直未能聯系上實際舉報人。 對于“舉報門”事件,復星醫藥董事長陳啟宇回應稱,復星醫藥高度重視本次事件,目前集團總部已派員到企業現場對生產管理進行嚴格檢查,核實情況。他同時稱,“集團旗下企業生產管理均在整體的指導監督之下運營,公司長期以來都是一家負責任的企業,會非常嚴格地接受監督和進行自查,如果檢查發現不合規的情況,將嚴肅追究嚴格處理。” 目前事關復星醫藥子公司被舉報的相關情況是否屬實,還待相關部門進一步調查核實。不過,“舉報門”事件已經對復星醫藥二級市場股價造成影響。8月31日,復星醫藥A股、H股雙雙跳空低開,其中A股一度觸及跌停板。 銷售費用連年增長 對于“舉報門”事件對復星醫藥經營層面的影響,該公司相關負責人士回應稱,2017年度,重慶醫工院營業收入占復星醫藥2017年度營業收入的0.42%,且重慶醫工院去年為虧損狀態,目前對經營層面沒有影響。 復星醫藥及控股子公司/單位主要從事藥品制造與研發、醫療服務、醫療器械與醫學診斷、醫藥分銷與零售,其中以藥品制造與研發為核心,并以醫療服務為發展重點。 8月27日,復星醫藥披露了今年中報,上半年實現營收118.59億元,同比增長41.97%,其中藥品制造研發收入占總營收的75%左右;歸屬于上市公司股東的凈利潤15.6億元,同比下降7.61%。這是復星醫藥繼2014年中期凈利潤同比下滑后,時隔4年再度出現凈利潤同比下滑情況。 對于這份中報成績單,多位醫藥行業券商分析師點評稱,業績低于預期。 復星醫藥解釋稱,凈利潤同比減少主要系報告期內資產處置收益減少導致非經常性損益較上年同期減少6113.32萬元,以及經常性損益較上年同期減少6745.57萬元所致。而經常性損益的減少主要受創新研發和業務布局的投入上升,以及利息費用增加等因素影響。 不過值得注意的是,今年上半年復星醫藥的銷售費用為38.04億元,同比增長66.64%,占到上半年營業收入的32%;管理費用為10.1億元,財務費用為3.52億元。復星醫藥稱,銷售費用增長是受部分產品銷售模式調整,新品和次新品的市場開拓和核心產品的銷售增長及新并購企業影響所致。 第一財經記者發現,從中期銷售費用來看,復星醫藥的銷售費用整體呈逐年增長態勢,到今年上半年的38.04億元為最高值。從年度數據來看,同樣反映了這個規律,到2017年度銷售費用達到最高,為57.91億元,相較2016年度增長56.33%。 在近三個年度的報告中,復星醫藥對銷售費用增長原因的解釋大致相同,主要為該公司核心產品銷售增長以及市場開拓深入所致。 上述相關負責人士稱,除了公司自身公告的原因外,因兩票制等整體大的環境也有一定的影響。“兩票制”是指藥品從藥廠賣到一級經銷商開一次發票,經銷商賣到醫院再開一次發票,以“兩票”替代目前常見的七票、八票,減少流通環節的層層盤剝,并且每個品種的一級經銷商不得超過2個。 [詳情]
復星醫藥董事長陳啟宇:公司產品“經得起查”,若有問題將嚴肅整改完善 每經記者 徐杰 實習記者 張瀟尹 每經編輯 張海妮 日前,復星醫藥(600196,SH)旗下重慶醫藥工業研究院有限責任公司(以下簡稱重慶醫工院)遭舉報:編造生產記錄、騙取藥品GMP(生產質量管理規范)證書、存在嚴重違反國家藥品生產管理法規行為。 8月31日午間,復星醫藥就此召開媒體澄清會。 會上,復星醫藥董事長陳啟宇通報稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。同時,復星醫藥進行了內部自查,目前已確認現有產品均根據已批準的工藝進行生產,對于生產工藝的調整均經相關藥監部門批準或備案,復星醫藥將實時掌握舉報和檢查的動態情況。 據陳啟宇介紹,重慶醫工院及其制藥公司主要從事仿制藥原料藥和中間體的研發、生產和銷售,復星醫藥持有其56%股份。2017年度,重慶醫工院實現營業收入7780萬元,占復星醫藥2017年度營業收入的0.42%,其年度凈虧損超過3000萬元。近兩年受內外部因素影響,重慶醫工院的經營仍處于虧損和投入的階段。 針對舉報信中“在2016年5月美國FDA現場檢查后,重慶醫工院得到了警示信”的內容,陳啟宇回應稱,公司針對該警示信已于2017年3月2日刊發了相關公告,并對時任的總經理等相關負責人給予嚴肅處理調整。彼時,重慶醫工院已形成新的領導班子,并積極推進相關整改工作。此外,陳啟宇進一步表示:“當時正值重慶醫工院新建原料藥基地和工廠搬遷,美國FDA現場檢查的是原來舊的生產設施,目前公司已經完全放棄(對)這些設施的使用。” 此外,針對今日上午重慶市食藥監局官網上的相關舉報信“失蹤”問題,陳啟宇回應稱,該舉報信并非“消失”,而是由于后續情況有所更新,其在會上通報了重慶市食藥監局的最新調查進展:目前重慶市食藥監局已組織主要由國家藥品GMP檢查員組成的調查組,對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的該局監管人員接受吃請、收受紅包進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前尚未聯系上實際舉報人。 陳啟宇表示復星醫藥將始終堅持以創新為導向,守住合規經營的底線。公司在多年前已建立內部的飛行檢查制度,掌握第一手的生產經營情況,同時接受來自政府部門、國內外監管機構、客戶等多方位的檢查。他進一步表示:“因此‘經得起查’是我們生產經營的基本工作,若在檢查中發現問題,我們會嚴肅地加以整改和完善。”[詳情]
復星醫藥子公司遭舉報后續:重慶藥監局稱所涉5條信息要逐一調查 復星醫藥子公司被舉報編造生產記錄一事,相關部門已經介入調查。 “接到舉報后,我們23日就派調查組入駐企業進行核查,所舉報的5條信息,我們都要逐一調查。目前專家正在就調查結果進行研判,會盡快向社會公布結果。”重慶藥監局一位工作人員對第一財經記者表示。 日前,重慶醫藥工業研究院有限責任公司(下稱“重慶醫工院”)員工舉報本公司違反國家藥品生產管理法規方面的造假行為比長春長生生物有過之無不及。 據復星醫藥30日發布的公告顯示,重慶醫工院制藥主要從事仿制藥原料藥和中間體的研發、生產和銷售。2017年度,重慶醫工院(合并口徑)實現營業收入人民幣7,780萬元,占復星醫藥集團2017年度營業收入的0.42%。 上述舉報信稱,近年來,重慶醫工院生產質量管理十分混亂,領導無視藥品生產管理法規,帶頭弄虛作假,造成了極其惡劣的后果,并屢次收到美國食品藥品監督管理局(下稱“FDA”)警告信。 8月31日上午,重慶市食藥監局通報了該事件的調查進展情況,稱主要由國家藥品GMP檢查員組成的調查組正對舉報的問題開展深入調查。駐局紀檢監察組對舉報反映的重慶市食藥監局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題。 重慶市食藥監局表示,正積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前一直未能聯系上實際舉報人。 根據天眼查資料顯示,重慶醫藥工業研究院為復星醫藥子公司,主要產品為原料藥。受此舉報信影響,31日上午開盤,復星醫藥的股價應聲大跌。 對此舉報信,復星醫藥30日晚間發布公告稱,2016年5月,FDA對重慶醫工院南岸區涂山路工廠進行檢查,針對其QC實驗室原料藥檢查中所發現的實驗室數據規范性不足出具警告信、提出整改要求。 2017年11月,FDA針對醫工院制藥(長壽區新場地)的質量體系進行批準前檢查。檢查后對于原料藥阿立哌唑提出一條483缺陷,該缺陷主要針對阿立哌唑檢測時所產生的無效OOS(偏差調查)不充分。 據悉,FDA的“ 483缺陷表”,又稱現場觀察報告(Inspectional Observation), 它是FDA 檢查官根據cGMP 規范,對醫藥企業的質量體系進行現場檢查過程中所發現的不符合cGMP 之處列出的總結清單。 白橡樹集團法規咨詢顧問李友翾對第一財經表示:“美國FDA對于藥企以及進口的企業都要進行現場檢查,按照cGMP的要求,進行逐項核查,如果不合格,檢察官會現場給出483缺陷表,并要求企業在15日內給予回復。一般情況下,此時的缺陷表不是公開,只是企業自己知道。如果FDA對于企業在15內的回復仍然有看法,將會發出警告信,對于進口的產品發出進口禁令,這個警告信同時公開在美國FDA網站。” 事實上,連續兩次被美國FDA發出警告信的重慶醫藥工業研究院,最主要的缺陷便是阿立哌唑檢測時所產生的無效OOS(偏差調查)不充分。 OOS是檢驗結果偏差(out of specification)的簡稱,意思是超標結果,是指實驗室結果不符合法定質量標準或企業內控標準的結果,包括穩定性研究中產品在有效期內不符合質量標準的結果。任何超出法定質量標準的產品都不能被放行,超出內控標準但仍符合法定標準的產品,應經過質量調查評估后由受權人決定是否放行。 “OOS是美國FDA的483缺陷列表中很重要的一項,是指企業產品質量檢測超過質量范圍,屬于不合格產品,可是在分析實驗室做出來結果又合格了,被稱為無效OOS。美國FDA如果看到這樣的無效OOS,一般將禁止產品流入市場,進行銷毀處理。”李友翾說。 [詳情]
復星醫藥涉嫌造假:美國FDA警告已兩年,重慶藥監才出手? | 新京報快評 羅志華 近日,重慶食藥監局官網公開了一則來自企業內部員工的舉報信,舉報稱復星醫藥旗下重慶醫藥工業研究院有限責任公司“幾乎所有生產工藝都沒有根據批準的工藝生產”“領導帶領員工大量編造生產記錄、檢驗記錄”“騙取藥品GMP證書”,自2016年起,美國食藥監局(FDA)兩次現場檢查均發現嚴重問題,并曾向該公司發出警告信。 重慶食藥監局回復稱已派出檢查組進駐企業,對舉報企業展開調查。 FDA對這家藥企的警告信在其官網上公開可查,且復星醫藥曾在2017年3月對FDA的警示信給予了披露,當時復星醫藥稱將進行有效整改,并積極與FDA溝通,爭取盡快解除警示。 由此看來,FDA查出的問題真實可信,復星醫藥的確存在編造生產記錄、檢驗記錄等嚴重違反藥品管理法規的情況。 但從FDA第一次跨國現場檢查,到現在已有兩年多,直到8月9日,復星醫藥的發債公告還提到了這封警示信,稱已進行了相應整改,再次表示要“爭取盡快解除警示”,這意味著這個警示至今尚未解除,企業整改仍在進行當中。 ▲8月30日,顯示在重慶市食藥監局官網的舉報信截圖 雖然重慶食藥監局收到舉報信后很快展開了調查,速度之快值得肯定。但公眾感到困惑的是,在美國FDI查出問題之后,是否也引起了重慶食藥監部門的高度重視,并采取了嚴格的監管舉措? 但我通過反復檢索,并未發現這兩年國內藥監部門就FDA公開發表的信息展開調查的消息。這至少表明,有關方面很可能沒有對這些極為重要的信息予以重視。 當然,這只是一種可能。另外一種可能則是,這也引起了監管部門的重視,也采取了相應的舉措。但這個時候,公眾要問的則是,為什么兩年過后,復興醫藥旗下公司仍然涉嫌存在造假行為?乃至,有內部員工發出了舉報信。 這次重慶藥監部門快速響應企業內部員工舉報,固然值得肯定。但也應該借此反思,此前的監管是否存在漏洞和不足。 不能不說的是,精神病藥造假,直接影響到藥品的質量,讓精神病患者的病情得不到較好地控制,這既有損精神病患者的健康,又對周圍人構成潛在的威脅,其危害之大可見一斑。 精神病藥造假雖然沒有疫苗造假的影響面廣,但精神病患者的病情得不到控制所導致的單個事件,往往后果十分嚴重,同樣應該引起高度重視。 如何監督藥企,有時的確充滿了困難,尤其在實驗數據和生產記錄等方面,很多都需現場取證,因此特別需要內部人舉報。但一味等內部人舉報的監督也過于消極,兩年前就應該掌握到的藥品造假線索,兩年后仍然人舉報同樣的內容,而這段時間,監管到底去了哪里?這才是這起事件最讓人擔心的地方。 文 | 羅志華(醫生)[詳情]
繼重慶市食藥監局在8月31日早間7點更新日前官方網站上發布的重慶醫藥工業研究院舉報信回復后,8月31日發現,在重慶市藥監局官網上,相關舉報信已經找不到蹤跡,點開此前保存的該郵件地址后出現彈窗“對不起,未找到該郵件”。[詳情]
新京報訊(記者李云琦)繼重慶市食藥監局在8月31日早間7點更新日前官方網站上發布的重慶醫藥工業研究院舉報信回復后,8月31日12:00新京報記者發現,在重慶市藥監局官網上,相關舉報信已經找不到蹤跡。記者點開此前保存的該郵件地址后出現彈窗“對不起,未找到該郵件”。 日前,重慶市食藥監局官網的“市政府公開信箱”中,出現了一封名為標題為《重慶醫藥工業研究院制藥公司嚴重違反藥品管理法》的舉報信,舉報人自稱“我們是重慶醫藥工業研究院有限責任公司的員工”。 8月30日,顯示在重慶市食藥監局官網的舉報信截圖 在舉報信中,舉報人稱重慶醫工院存在“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書”、曾“集中力量做重慶市食藥監局工作,又請吃飯,又送紅包”等行為。 8月31日,復星醫藥證券部回復新京報記者稱,“我們內部看是沒有任何問題的”。復星醫藥相關宣傳人員對新京報記者表示,“公司已經注意到早上重慶市食藥監局的回應,發現舉報所留信息不是舉報人真實信息,一直未能聯系上實際舉報人。”“公司將密切關注信件所涉事項的后續進展,并及時與相關方保持有效溝通”。 今日早7點,重慶食藥監局官網更新舉報信稱,正在對重慶醫工院展開深入調查。上午10點,新京報記者致電重慶市食藥監局,相關工作人員回應記者稱,已經組織工作組對重慶醫工院進行調查,“調查的情況我們會及時公開”。 點擊原舉報信地址后,出現的彈窗頁面 31日12點時,記者點開此前保存的舉報信鏈接,發現舉報信已經無法打開,而是出現彈窗窗口顯示“對不起,未找到該郵件”。在重慶市食藥監局2018年8月31日至8月24日的相關舉報信目錄中,記者也均未發現以《重慶醫藥工業研究院制藥公司嚴重違反藥品管理法》為標題的舉報信。 記者隨即多次聯系重慶市食藥監局,電話均無人接聽。 編輯:馬小龍[詳情]
復星醫藥董事長陳啟宇:高度重視“舉報事件” 堅持合規生產 上證報訊(記者 祁豆豆)近日,重慶市食品藥品監管局公開信箱顯示,收到有關“重慶醫藥工業研究院制藥公司嚴重違反藥品管理法”的舉報信件,舉報涉及醫工院“原料藥工藝造假”。8月31日上午,復星醫藥董事長陳啟宇向上證報獨家回應,復星醫藥高度重視本次事件,目前集團總部已派員到企業現場對生產管理進行嚴格檢查,核實情況。“集團旗下企業生產管理均在整體的指導監督之下運營,公司長期以來都是一家負責任的企業,會非常嚴格地接受監督和進行自查,如果檢查發現不合規的情況,將嚴肅追究嚴格處理。”陳啟宇表示。 針對舉報事件,重慶市食品藥品監管局回復稱,已啟動對被投訴舉報企業的相關調查工作,現已派出檢查組進駐企業,如發現存在違法違規生產行為,將依法進行查處。 8月31日早間,重慶市食品藥品監管局公開信箱更新了調查進展情況,并公開回復舉報人信息,稱“由我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報涉及的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是個人真實信息,目前我們一直未能聯系上實際舉報人。” 公開資料顯示,重慶醫工院是復星醫藥控股孫公司。目前重慶醫工院及其制藥公司重慶醫工院制藥有限公司(簡稱“醫工院制藥”)主要從事仿制藥原料藥和中間體的研發、生產和銷售。2017年度,重慶醫工院(合并口徑)實現營業收入7780萬元,對應復星醫藥集團2017年度營業收入的0.42%,實現凈利潤-3461 萬元。其中,境外銷售收入占比約26%。 復星醫藥8月30日晚間公告說明有關情況稱,根據醫工院制藥自查,現有產品均根據已批準的工藝進行生產。在生產過程中,生產工藝的調整均經相關藥監部門批準或備案。同時,根據經營的需要,重慶醫工院于2016年向醫工院制藥轉移了阿立哌唑、培美曲塞二鈉產品批件,于2018年轉移了蔗糖鐵產品批件,并已通過藥監部門的現場檢查和批準。此外,醫工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報,2018年提供給上海中西三維藥業有限公司的產品僅作為其制劑研究之用。 8月31日,復星醫藥董事長陳啟宇接受上證報采訪稱,近年來,公司在醫藥創新、生產質量管理水平提升等各方面作出努力,旗下企業都在嚴格、嚴謹遵循集團對醫藥研發、生產、制造、銷售的所有流程合規化的管控要求。同時,復星醫藥近兩年也在內部發起“精益管理”的工作,旨在提升優化生產運營管理體系水平。公司多年以來也一直保持對子公司內部飛行檢查的機制。 “集團旗下企業生產管理均在整體的指導監督下運營,公司長期以來是一家負責任的企業,會非常嚴格地接受監督和進行自查,如果檢查發現不合規情況,將嚴肅追究嚴格處理。”陳啟宇表示。 陳啟宇希望:投資者及關注復星醫藥的人士要相信公司,公司是嚴格遵守生產質量經營管理體系要求的;要相信公司能夠處理好本次事件;相信監管部門能夠非常客觀嚴謹地進行檢查工作。企業也一定會根據監管部門的相關檢查結果,做好后續工作。[詳情]
每經記者 陳晴 每經編輯 張海妮 復星醫藥(600196,SH)二級子公司遭舉報事件有了新進展。8月31日早間和8月30日深夜,重慶市食品藥品監管局(以下簡稱重慶食藥監局)和復星醫藥相繼發布最新進展或說明。 重慶食藥監局:正對舉報的問題開展深入調查 此次重慶食藥監局官網發布的舉報信來自重慶醫藥工業研究院有限責任公司(以下簡稱重慶醫工院)內部員工,其稱“我院制藥公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及”。 舉報信提到了多方面的舉報內容,包括:重慶醫工院存在“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”、“在2016年5月美國FDA現場檢查后,得到了警示信!”“2017年11月美國FDA再次現場檢查,又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI),”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書” “主要供應上海中西藥業的產品---阿力哌唑,工藝作了重大改變““ 集中力量做重慶市藥監局的工作,又請吃飯,又送紅包”等行為。 對于上述舉報事件,8月31日早間,重慶食藥監局公開信箱更新了調查進展:我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前我們一直未能聯系上實際舉報人。 重慶食藥監局稱,“熱忱歡迎舉報人或知情人士負責任地向我局提供全面、客觀、詳實的證據,我們一定認真核查,依法依規嚴肅處理。” 復星醫藥深夜發布事件說明 舉報事件發生后,8月30日深夜,復星醫藥也發布了“關于媒體報道的有關情況”的說明。根據公告,重慶醫工院及其制藥公司重慶醫工院制藥有限責任公司(以下簡稱醫工院制藥)主要從事仿制藥原料藥和中間體的研發、生產和銷售,主要客戶為歐美及中國的制劑企業。其中重慶醫工院是復星醫藥的二級控股子公司。 《每日經濟新聞》記者注意到,舉報信中的部分舉報情況得到了復星醫藥的確認,例如“在2016年5月美國FDA現場檢查后,得到了警示信!”復星醫藥稱公司曾于2017年3月發布相關公告。 不過,針對舉報信中提到的“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”,復星醫藥稱,根據醫工院制藥自查,現有產品均根據已批準的工藝進行生產。在生產過程中,對于生產工藝的調整均經相關藥監部門批準或備案。 針對舉報信中提到的“主要供應上海中西藥業的產品---阿力哌唑,工藝作了重大改變”,復星醫藥回應稱,根據經營的需要,重慶醫工院于2016年向醫工院制藥轉移了阿立哌唑、培美曲塞二鈉產品批件,于2018年轉移了蔗糖鐵產品批件,并已通過藥監部門的現場檢查和批準;醫工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報,2018年提供給上海中西三維藥業有限公司的產品僅作為其制劑研究之用。 復星醫藥還稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。[詳情]
復星醫藥:重慶醫工院現有產品均根據已批準工藝生產 上證報訊(記者 祁豆豆)近日,重慶市食品藥品監管局(簡稱“重慶食藥監局”)公開信箱顯示收到有關“重慶醫藥工業研究院制藥公司嚴重違反藥品管理法”的信件(簡稱“信件”)。針對上述信件內容,經自查核實,復星醫藥已于8月30日晚發布公告就相關情況進行說明。 據公告,重慶醫藥工業研究院有限責任公司(簡稱“重慶醫工院”)及其制藥公司重慶醫工院制藥有限責任公司(簡稱“醫工院制藥”)主要從事仿制藥原料藥和中間體的研發、生產和銷售。2017年度,重慶醫工院(合并口徑)實現營業收入7780萬元,占復星醫藥集團2017年度營業收入的0.42%,實現凈利潤-3461 萬元。其中,境外銷售收入占比約 26% 復星醫藥表示,經核實,2016年5月美國食品藥品監督管理局(簡稱“FDA”)對重慶醫工院南岸區涂山路工廠進行檢查,針對其QC實驗室原料藥檢查中所發現的實驗室數據規范性不足出具警告信、提出整改要求。根據上述整改要求,已對重慶醫工院時任主要領導及相關責任人員進行了處理調整,并在推進相關整改工作,力爭盡快通過FDA現場檢查。 2017年11月,FDA針對醫工院制藥(長壽區新場地)的質量體系進行批準前檢查。檢查后對于原料藥阿立哌唑提出一條“483缺陷”,該缺陷主要針對阿立哌唑檢測時所產生的無效OOS(偏差調查)不充分。目前,醫工院制藥已經在FDA的規范指引下展開整改。 此外,根據醫工院制藥自查,現有產品均根據已批準的工藝進行生產。在生產過程中,對于生產工藝的調整均經相關藥監部門批準或備案。 同時,根據經營的需要,重慶醫工院于2016年向醫工院制藥轉移了阿立哌唑、培美曲塞二鈉產品批件,于2018年轉移了蔗糖鐵產品批件,并已通過藥監部門的現場檢查和批準。此外,醫工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報,2018年提供給上海中西三維藥業有限公司的產品僅作為其制劑研究之用。 目前重慶食藥監局已就該信件所反映的內容開展相關調查,并已于8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。 據悉,重慶是復星醫藥積極布局的區域之一。復星醫藥總裁兼CEO吳以芳表示,一直以來,復星醫藥堅持規范管理和創新發展。公司將密切關注信件所涉事項的后續進展,并及時與相關方保持有效溝通;同時,將進一步要求下屬企業強化自律管理。 8月31日早上,重慶市食品藥品監管局公開信箱更新了調查進展情況并公開回復舉報人信息,稱“我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前我們一直未能聯系上實際舉報人。”[詳情]
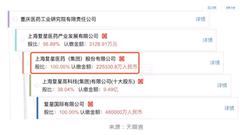
復星醫藥旗下被舉報造假的重慶醫工院,此前已有“案底” 重慶醫藥工業研究院有限責任公司(以下簡稱“重慶醫工院”)遭內部員工舉報公司造假一事,讓母公司復星醫藥連帶陷入到輿論風口浪尖上。8月30日深夜,復星醫藥發布公告回應稱,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于 2018 年 8月 23 日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。 而此次被卷入風波中的重慶醫工院,到底是一家怎樣的公司? 據復星醫藥公告顯示,重慶醫工院及其制藥公司重慶醫工院制藥有限責任公司(以下簡稱“醫工院制藥” )主要從事仿制藥原料藥和中間體的研發、生產和銷售,主要客戶為歐美及中國的制劑企業。 從持股比例看,截至目前,復星醫藥持有重慶醫工院57.74%股權,而重慶醫工院又持有醫工院制藥70.37%股權。 2017 年度,重慶醫工院(合并口徑)實現營業收入 7780 萬元,占復星醫藥 2017 年度營業收入的 0.42%;實現歸屬于母公司凈利潤則虧損3461 萬元。其中,境外銷售收入占比約 26%。 2017年,重慶醫工院及醫工院制藥生產的產品主要涵蓋羅庫溴銨 8 號物、培美曲塞二鈉、蔗糖鐵、阿立哌唑這四款中間體或原料藥,對應的適應癥分別是骨骼肌松弛藥、抗腫瘤藥、貧血癥、精神分裂癥。 其中,重慶醫工院的原料藥阿立哌唑主要出現在員工舉報信中。舉報中提到稱,重慶醫工院主要供應上海中西藥業的產品---阿力哌唑,工藝作了重大改變,不但沒有根據國家批準的工藝生產,而且經2017年11月美國FDA再次現場檢查發現了嚴重違反藥品管理法規的行為。 據第一財經記者查閱國家食品藥品監督管理局數據顯示,目前國內共有4家公司擁有阿立哌唑原料藥批文。除了重慶醫工院外,另外三家公司分別是成都弘達藥業有限公司、江蘇豪森藥業集團有限公司、江蘇恩華藥業有限公司。 復星醫藥公告顯示,2017年,重慶醫工院生產的阿立哌唑僅銷售中國境內,2017年度銷售收入僅有164萬元,也是上述四款藥物中銷售規模最小的一款藥。 復星醫藥表示,根據經營的需要,重慶醫工院于 2016 年向醫工院制藥轉移了阿立哌唑、培美曲塞二鈉產品批件,于 2018 年轉移了蔗糖鐵產品批件,并已通過藥監部門的現場檢查和批準。醫工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報, 2018 年提供給上海中西三維藥業有限公司的產品僅作為其制劑研究之用。 復星醫藥在公告中也承認,重慶醫工院此前已有相關不合格的“案底”。復星醫藥表示,2016 年 5 月美國食品藥品監督管理局(以下簡稱“FDA”)對重慶醫工院南岸區涂山路工廠進行檢查,針對其 QC 實驗室原料藥檢查中所發現的實驗室數據規范性不足出具警告信、提出整改要求。根據上述整改要求,已對重慶醫工院時任主要領導及相關責任人員進行了嚴肅處理調整,并在積極推進相關整改工作, 力爭盡快通過 FDA 現場檢查。另外,2017 年 11 月,FDA 針對醫工院制藥(長壽區新場地)的質量體系進行批準前檢查。檢查后對于原料藥阿立哌唑提出一條 483 缺陷,該缺陷主要針對阿立哌唑檢測時所產生的無效 OOS(偏差調查)不充分。目前,醫工院制藥已經在 FDA 的規范指引下展開整改。 受重慶醫工院被舉報一事沖擊,8月31日早間開盤后,復星醫藥A、H股兩地股價再度雙雙出現大跳水,截至9點42分時,雙雙跌幅逾9%。[詳情]
作者 盛蘭哲 發自上海 新浪財經訊 8月31日消息,8月30日晚間,復星醫藥披露關于媒體報道說明公告,就近日重慶食藥監局收到有關《重慶醫藥工業研究院制藥公司嚴重違反藥品管理法》的信件作出回應。 8月24日,重慶市食品藥品監管局公開信箱公布了一條醫藥研究公司內部員工舉報公司造假的信息。舉報人自稱為重慶醫藥工業研究院有限責任公司的員工。 其舉報內容稱,重慶醫工院幾乎所有生產工藝都沒有根據批準的工藝生產,領導帶領員工大量編造生產記錄、檢驗記錄。對此,復星醫藥回應稱,根據醫工院制藥自查,現有產品均根據已批準的工藝進行生產。在生產過程中,對于生產工藝的調整均經相關藥監部門批準或備案。 而舉報信中引起較大關注的是主要供應上海中西藥業的產品——阿力哌唑的工藝作了重大改變,嚴重違反藥品管理法規,而重慶醫工院對圖譜進行縮小積分面積計算,操縱產品合格出廠。對此,復星醫藥表示,醫工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報,2018 年提供給上海中西三維藥業有限公司的產品僅作為其制劑研究之用。 該員工還舉報稱,重慶醫工院在2016年5月美國FDA現場檢查后,得到了警告信。2017年11月美國FDA再次現場檢查,又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI),現在正在等待處理。對此,復星醫藥表示,2016年5月美國FDA對重慶醫工院南岸區涂山路工廠 QC 實驗室原料藥檢查中所發現的實驗室數據規范性不足出具警告信、提出整改要求。根據上述整改要求,已對重慶醫工院時任主要領導及相關責任人員進行了嚴肅處理調整,并在積極推進相關整改工作,力爭盡快通過 FDA 現場檢查。2017年11月,FDA 針對醫工院制藥(長壽區新場地)的質量體系進行批準前檢查。檢查后對于原料藥阿立哌唑提出一條 483 缺陷,該缺陷主要針對阿立哌唑檢測時所產生的無效 OOS(偏差調查)不充分。目前,醫工院制藥已經在 FDA 的規范指引下展開整改。 舉報信中還稱,重慶醫工院欺騙上級藥品監督管理部門,騙取藥品GMP證書。由于實際生產工藝與批準工藝不一致,在向重慶市食品藥品監督管理局申請場地轉移和GMP證書過程中,蔗糖鐵、阿力哌唑、培美曲塞二鈉等產品用老工藝編造成套的生產和檢驗記錄,蒙騙上級機關和檢查人員。并且,目前院里領導正在組織公關部門,就阿力哌唑、培美曲塞二鈉等二個產品重大工藝改變,集中力量做重慶市藥監局的工作,使其得到重慶市藥監局的批準備案。對此,復星醫藥回應稱,根據經營的需要,重慶醫工院于 2016 年向醫工院制藥轉移了阿立哌唑、培美曲塞二鈉產品批件,于 2018 年轉移了蔗糖鐵產品批件,并已通過藥監部門的現場檢查和批準。 對于舉報信,重慶市食品藥品監管局回復稱:局黨組高度重視,已啟動對投訴舉報的企業開展相關調查工作,現已派出檢查組進駐企業,如發現企業存在舉報內容相關的違法違規生產行為,食品藥品監管局將依法進行查處。如有新的查辦結果會再次反饋。 復星醫藥也表示,重慶食藥監局已就該信件所反映的內容開展相關調查,并已于 2018年 8月 23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。公司將密切關注信件所涉事項的后續進展,并履行信息披露義務。[詳情]
推薦閱讀: 專題:復星醫藥子公司暴雷 比長生有過之無不及? 精神病藥涉嫌造假?復星醫藥旗下公司遭內部舉報 復星醫藥聲明:已對責任人嚴肅處理 力爭通過FDA檢查 又一個長生生物?復星醫藥旗下公司遭員工舉報 新浪財經訊 昨日,有媒體報道稱重慶醫藥工業研究院制藥公司內部員工向重慶食藥監局舉報,該公司嚴重違反藥品管理法,甚至在“在違反國家藥品生產管理法規方面比長春長生生物有過之無不及”。 對此,今日早間,重慶市食品藥品監管局公開信箱更新了調查進展,稱“我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前我們一直未能聯系上實際舉報人。” [詳情]
【相關閱讀】復星醫藥子公司被公開舉報:美國FDA曾警示其數據造假 復星醫藥子公司被舉報編造生產記錄 回應:不符合事實 新浪財經訊 繼長春長生生物違法違規生產狂犬疫苗事件引發輿論強烈關注后,復星醫藥旗下公司被爆出違規生產藥品,編造生產記錄、檢驗記錄等現象。 重慶食藥監局官網的一則公開舉報稱,復星醫藥旗下重慶醫藥工業研究院有限責任公司“生產質量管理十分混亂”、“騙取藥品GMP證書”,自2016年起,美國食藥監局(FDA)兩次現場檢查均發現嚴重問題,并曾向該公司發出警告信。 復星醫藥今日發布聲明表示,2016年5月FDA對重慶醫工院南岸區涂山路工廠進行檢查,針對其QC實驗室原料藥檢查中所發現的實驗室數據規范性不足出具警告信、提出整改要求。根據上述整改要求,已對重慶醫工院時任主要領導及相關責任人員進行了嚴肅處理調整,并在積極推進相關整改工作,力爭盡快通過FDA現場檢查。 復星醫藥關于媒體報道的有關情況說明 近日,重慶市食品藥品監管局(以下簡稱“重慶食藥監局”)公開信箱顯示收到有關“重慶醫藥工業研究院制藥公司嚴重違反藥品管理法”的信件(以下簡稱“信件”)。該信件備受媒體、投資者和公眾關注,公司管理層高度重視,并在第一時間針對上述信件內容嚴格自查核實,已于8月30日晚發布公告就相關情況進行說明。 重慶醫藥工業研究院有限責任公司(以下簡稱“重慶醫工院”)及其制藥公司重慶醫工院制藥有限責任公司(以下簡稱“醫工院制藥”)主要從事仿制藥原料藥和中間體的研發、生產和銷售。 2017年度,重慶醫工院(合并口徑)實現營業收入人民幣7,780萬元,占復星醫藥集團2017年度營業收入的0.42%。 主要核實內容說明如下: 1、2016年5月美國食品藥品監督管理局(以下簡稱“FDA”)對重慶醫工院南岸區涂山路工廠進行檢查,針對其QC實驗室原料藥檢查中所發現的實驗室數據規范性不足出具警告信、提出整改要求,詳情請見本公司于2017年3月2日刊發的相關公告。根據上述整改要求,已對重慶醫工院時任主要領導及相關責任人員進行了嚴肅處理調整,并在積極推進相關整改工作,力爭盡快通過FDA現場檢查。 2017年11月,FDA針對醫工院制藥(長壽區新場地)的質量體系進行批準前檢查。檢查后對于原料藥阿立哌唑提出一條483缺陷,該缺陷主要針對阿立哌唑檢測時所產生的無效OOS(偏差調查)不充分。目前,醫工院制藥已經在FDA的規范指引下展開整改。 2、此外,根據醫工院制藥自查,現有產品均根據已批準的工藝進行生產。在生產過程中,對于生產工藝的調整均經相關藥監部門批準或備案。 3、根據經營的需要,重慶醫工院于2016年向醫工院制藥轉移了阿立哌唑、培美曲塞二鈉產品批件,于2018年轉移了蔗糖鐵產品批件,并已通過藥監部門的現場檢查和批準。 4、醫工院制藥的原料藥阿立哌唑目前在進行工藝變更的申報,2018年提供給上海中西三維藥業有限公司的產品僅作為其制劑研究之用。 5、重慶食藥監局已就該信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。 我們注意到,8月31日早上,重慶市食品藥品監管局公開信箱更新了調查進展情況并公開回復舉報人信息,稱“我局組織的主要由國家藥品GMP檢查員組成的調查組,正對舉報的問題開展深入調查;駐局紀檢監察組對舉報反映的我局監管人員接受吃請、收受紅包的情況進行了初步核實,暫未發現有違法違紀問題;積極主動與舉報人進行聯系,但發現其所留信息不是舉報人真實信息,目前我們一直未能聯系上實際舉報人。” 一直以來,復星醫藥堅持規范管理和創新發展。公司將密切關注信件所涉事項的后續進展,并及時與相關方保持有效溝通;同時,將進一步要求下屬企業強化自律管理。[詳情]
推薦閱讀: 專題:復星醫藥子公司暴雷 比長生有過之無不及? 復星醫藥聲明:已對責任人嚴肅處理 力爭通過FDA檢查 又一個長生生物?復星醫藥旗下公司遭員工舉報 來源:大摩財經(ID:damofinance) 重慶食藥監介入調查 復星醫藥會是第二個長生生物嗎? 重慶食藥監局官網的一則公開舉報稱,復星醫藥旗下重慶醫藥工業研究院有限責任公司“生產質量管理十分混亂”、“騙取藥品GMP證書”,自2016年起,美國食藥監局(FDA)兩次現場檢查均發現嚴重問題,并曾向該公司發出警告信。 舉報人自稱為重慶醫藥工業研究院內部員工。舉報稱,問題更嚴重的是該公司生產的阿力哌唑——一種治療精神分裂癥的藥品——存在私自更改生產工藝、被美國FDA現場檢查不合格,嚴重違法藥品管理法規。 精神病治不好,都是因為精神病藥有問題?如果是真的,違規生產疫苗的長生生物殷鑒不遠,復星醫藥麻煩大了。 最關鍵的是,美國FDA的警告信在其官網公開可查,且復星醫藥曾在2017年3月對這封警告信予以過公告披露。這也說明,內部員工舉報信并非完全空穴來風。 針對此舉報,重慶食藥監局已于8月24日回復稱,已啟動對該企業調查,現已派出檢查組進駐重慶醫藥工業研究院。 復星醫藥為重慶醫藥工業研究院大股東,持有56.89%股權。國有控股的重慶醫藥集團持有另43.11%股權。 目前復星醫藥尚未正式對外披露該舉報是否屬實。 公開舉報 重慶食藥監局官網公開回復這封舉報信發生在一周前,但直到今天才引起了外界的極大關注。 舉報信全文如下: 我們是重慶醫藥工業研究院有限責任公司的員工。最近從電視上看到關于長春長生生物公司嚴重違反國家藥品生產管理法規的系列報道,我們認為,我院制藥公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及。為了對國內外人民的生命健康負責,特向上級機關反映如下,務請盡快調查糾正: 1.我院制藥公司近年來,生產質量管理十分混亂,領導無視藥品生產管理法規,帶頭弄虛作假,造成了極其惡劣的后果。在2016年5月美國FDA現場檢查后,得到了警告信!2017年11月美國FDA再次現場檢查,又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI),現在正在等待處理(以上可以查閱美國FDA出具的483文件); 2.我院制藥公司生產的主要產品(原料藥)幾乎同時供應國內外市場,幾乎所有生產工藝都沒有根據批準的工藝生產,絕大部分產品工藝作了重大改變。于是,領導帶領員工大量編造生產記錄、檢驗記錄; 3.欺騙上級藥品監督管理部門,騙取藥品GMP證書。我院制藥公司生產場地原來在重慶南岸區,因環保在重慶長壽區建了新的生產基地。由于實際生產工藝與批準工藝不一致,在向重慶市食品藥品監督管理局申請場地轉移和GMP證書過程中,用老工藝編造成套的生產和檢驗記錄,蒙騙上級機關和檢查人員(例如:蔗糖鐵、阿力哌唑、培美曲塞二鈉等); 4.更為嚴重的是,主要供應上海中西藥業的產品---阿力哌唑,工藝作了重大改變,不但沒有根據國家批準的工藝生產,而且經2017年11月美國FDA再次現場檢查發現了嚴重違反藥品管理法規的行為,一次檢查不合格,進行二次檢查,據說為了發貨,根據領導要求,嚴重違反規定,對圖譜進行縮小積分面積計算,操縱產品合格出廠(可見美國FDA出具的483文件); 5.目前院里領導正在組織公關部門,就阿力哌唑、培美曲塞二鈉等二個產品重大工藝改變,集中力量做重慶市藥監局的工作,又請吃飯,又送紅包,使其得到重慶市藥監局的批準備案。據說,重慶市藥監局安監處負責人已經答應辦理。 以上反映的我院嚴重違反國家藥品管理法規的情況是我們親身經歷和了解到的事實,并請從速查證。 重慶食藥監局公開回復稱: 我局黨組高度重視,已啟動對您投訴舉報的企業開展相關調查工作,現已派出檢查組進駐企業,如發現企業存在舉報內容相關的違法違規生產行為,我局將依法進行查處。如有新的查辦結果我局再向您反饋。 舉報信中提到,FDA現場檢查后曾經向重慶醫藥工業研究院發出警告信。經查,該警告信是FDA于2017年2月14日發出的,主要針對2016年5月16日至19日FDA對重慶醫藥工業研究院南岸區涂山路工廠QC實驗室原料藥檢查中所發現的實驗室數據規范性問題。 FDA在現場檢查中發現,該院產品現行有效的藥物活性成分(API)與“良好生產規范”(CGMP)存在重大偏差。FDA在警示信中指出,審查過程中發現該院人為刪除原始的不符合規范的數據或不希望看到的試驗結果,以通過修改后的試驗結果和不完整記錄來支撐藥品發布。 復星醫藥曾在2017年3月對上述警示信予以披露。當時復星醫藥稱將進行有效整改,并積極與FDA溝通,爭取盡快解除警示。值得注意的是,直到最近即8月9日,復星醫藥的發債公告又提到了這封警示信,稱已進行了相應整改,再次表示要“爭取盡快解除警示”,這也意味著至今警示尚未解除。 內部員工舉報信還提到,2017年11月美國FDA再次現場檢查,重慶醫藥工業研究院又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI),現在正在等待處理。舉報信提示,以上舉報可以查閱美國FDA出具的483文件。 波及“奧派” 舉報信中最讓人心驚的是提到了一種精神分裂癥治療藥品——阿力哌唑,并稱重慶醫藥工業研究院生產的阿力哌唑主要供給上海中西藥業。 阿力哌唑為處方藥,中西藥業生產的奧派阿力哌唑片是國內最主要的精神分裂癥治療藥品之一。事實上,目前中國只有四家企業擁有阿立哌唑藥品文號,即成都康弘、大冢制藥、中西藥業、江蘇恩華,其中中西藥業的“奧派”、成都康弘的“博思清”最為知名,可查詢數據顯示,2013、2014年奧派與博思清的市場份額之和達到75%左右,在國內市場占據統治地位。 舉報信稱,“更為嚴重的是,主要供應上海中西藥業的產品---阿力哌唑,工藝作了重大改變,不但沒有根據國家批準的工藝生產,而且經2017年11月美國FDA再次現場檢查發現了嚴重違反藥品管理法規的行為,一次檢查不合格,進行二次檢查,據說為了發貨,根據領導要求,嚴重違反規定,對圖譜進行縮小積分面積計算,操縱產品合格出廠。” 大摩財經查詢到的數據顯示,2016年國內阿立哌唑市場規模約在8.74億元人民幣多,其中樣本醫院銷售規模1.4億。 復星醫藥為知名企業復星集團旗下醫藥產業集團,法人代表兼董事長為陳啟宇。中西藥業自2010年起已被上海醫藥集團合并。 [詳情]
8月24日,重慶市食品藥品監管局公開信箱公布了一條醫藥研究公司內部員工舉報公司造假的信息。 該舉報人聲稱,其本人為重慶醫藥工業研究院有限責任公司的員工,最近從電視上看到關于長春長生生物公司嚴重違反國家藥品生產管理法規的系列報道,他/她認為,“其所在公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及。” 對此,重慶醫藥工業研究院回應《每日經濟新聞》,“舉報信中提到的情況不符合事實,目前市藥監局還在做調查。” 該舉報人具體舉報公司違反國家藥品管理法規的情況如下: 1.領導無視生產管理法規,帶頭弄虛作假,編造生產紀錄、檢驗紀錄。公司在2016年5月受到美國FDA警告后,于2017年11月再次被FDA基于最差評價結果。 2.欺騙上級藥品監督管理部門,騙取藥品GMP(生產質量管理規范)證書。在向重慶市食品藥品監督管理局申請場地轉移和GMP證書過程中,用老工藝編造成套的生產和檢驗記錄,蒙騙上級機關和檢查人員。 3.產品阿力哌唑生產不合格。違反規定,對圖譜進行縮小積分面積計算,操縱產品合格出廠。 對于上述舉報信,重慶市食品藥品監管局回復稱:局黨組高度重視,已啟動對投訴舉報的企業開展相關調查工作,現已派出檢查組進駐企業,如發現企業存在舉報內容相關的違法違規生產行為,食品藥品監管局將依法進行查處。如有新的查辦結果會再次反饋。 《每日經濟新聞》記者從天眼查數據獲悉,重慶醫藥工業研究院有限責任公司的大股東為上海復星醫藥產業發展有限公司,持股比例為56.89%;另一家股東為重慶醫藥(集團)股份有限公司,持股比例為43.11%。而重慶醫藥(集團)股份有限公司由重慶化醫控股(集團)公司持有74.99%股權,重慶化醫控股(集團)公司則是上市公司重藥控股(000950,SZ)控股股東。 針對此次員工舉報,8月30日《每日經濟新聞》記者致電重慶醫藥工業研究院,工作人員表示,“公司已經知悉相關情況,但舉報信中提到的情況不符合事實。目前市藥監局還在做調查,公司將等調查結果出來以后再做公開解釋。” 記者又致電重藥控股,公司工作人員回應稱,被舉報公司不久前剛剛經歷了監管部門的飛行檢查,完全沒有問題。該工作人員同時表示,舉報事件和上市公司沒有關系。 [詳情]
來源:火線財經 如果說昨天中弘股份的地天板,還可以理解為,陷入仙股絕境大股東求生欲望強烈,小動作不斷的話。那么今天ST長生這個地天板就顯得頗為無厘頭了,漲停板上的賣單和買單仿佛在互道一聲傻X。 要知道,ST長生自曝出問題疫苗事件復牌后,已經連續32個跌停,打破A股連續跌停紀錄并連續兩天創造新的紀錄,與此同時多家基金公司將ST長生的估值一路下調,甚至下調至“估值為0”。 長生的股吧里充斥著對今天買入者的咒罵,帶血的股票就這樣被放過?怎么可能的事呢,資本市場歸根結底是一個博弈的場所,有人覺得一文不值,也會有人虎視眈眈,直到到達心理價位,然后咬住不放。 當然這個博弈的過程中,也是充滿著一系列的局,在ST長生身上,我們暫時將其看作是一次自救,樓市“漲價去庫存”手法在股市的映射。不是深圳房租也在設置漲停板了么。 復星醫藥子公司暴雷 醫藥股真的是命途多舛啊,這才處理過長生生物,復星醫藥的子公司也出事了,重慶醫藥工業研究院有限責任公司遭內部員工舉報,并且稱在違反國家藥品生產管理法規方面比長春長生生物有過之無不及。 公司原料藥幾乎所有生產工藝都沒有根據批準的工藝生產,領導帶領員工大量編造生產記錄、檢驗記錄。為了工藝改變得到通過,公司領導集中力量做重慶市藥監局的工作,又請吃飯,又送紅包,使其得到重慶市藥監局的批準備案。 還可以再簡練些→公司原料藥幾乎所有生產工藝都沒有根據批準的工藝生產,大量編造生產記錄、檢驗記錄。請吃飯,送紅包,使其得到批準備案。 食品藥品監管局對此回應稱,黨組高度重視,已啟動對投訴舉報的企業開展相關調查工作,現已派出檢查組進駐企業,如發現企業存在舉報內容相關的違法違規生產行為,將依法進行查處。 舉報信全文 重慶醫藥工業研究院制藥公司嚴重違反藥品管理法 我們是重慶醫藥工業研究院有限責任公司的員工。最近從電視上看到關于長春長生生物公司嚴重違反國家藥品生產管理法規的系列報道,我們認為,我院制藥公司在違反國家藥品生產管理法規方面比長春長生生物有過之無不及。為了對國內外人民的生命健康負責,特向上級機關反映如下,務請盡快調查糾正: 1.我院制藥公司近年來,生產質量管理十分混亂,領導無視藥品生產管理法規,帶頭弄虛作假,造成了極其惡劣的后果。在2016年5月美國FDA現場檢查后,得到了警告信!2017年11月美國FDA再次現場檢查,又出現了嚴重違反藥品管理法規的情況,得到了美國FDA給予的最差評價結果(OVI),現在正在等待處理(以上可以查閱美國FDA出具的483文件); 2.我院制藥公司生產的主要產品(原料藥)幾乎同時供應國內外市場,幾乎所有生產工藝都沒有根據批準的工藝生產,絕大部分產品工藝作了重大改變。于是,領導帶領員工大量編造生產記錄、檢驗記錄; 3.欺騙上級藥品監督管理部門,騙取藥品GMP證書。我院制藥公司生產場地原來在重慶南岸區,因環保在重慶長壽區建了新的生產基地。由于實際生產工藝與批準工藝不一致,在向重慶市食品藥品監督管理局申請場地轉移和GMP證書過程中,用老工藝編造成套的生產和檢驗記錄,蒙騙上級機關和檢查人員(例如:蔗糖鐵、阿力哌唑、培美曲塞二鈉等); 4.更為嚴重的是,主要供應上海中西藥業的產品---阿力哌唑,工藝作了重大改變,不但沒有根據國家批準的工藝生產,而且經2017年11月美國FDA再次現場檢查發現了嚴重違反藥品管理法規的行為,一次檢查不合格,進行二次檢查,據說為了發貨,根據領導要求,嚴重違反規定,對圖譜進行縮小積分面積計算,操縱產品合格出廠(可見美國FDA出具的483文件); 5.目前院里領導正在組織公關部門,就阿力哌唑、培美曲塞二鈉等二個產品重大工藝改變,集中力量做重慶市藥監局的工作,又請吃飯,又送紅包,使其得到重慶市藥監局的批準備案。據說,重慶市藥監局安監處負責人已經答應辦理。 復星醫藥尾盤殺跌 復星醫藥周一剛剛強勢漲停,郭廣昌也強調復星凈負債率將控制在60%以下,這會兒利空一出,復星醫藥尾盤殺跌,中陰了。 據8月27日晚,復星醫藥發布2018年度半年報獲知:營業收入實現118.5億元 人民幣(單位下同),較同期增長41.97%;凈利潤收入實現15.6億,較同期減少7.61%。每股收益為0.63元,較同期減少10.0%。 復星醫藥近幾年凈利潤增速保持兩位數高速增長,今年上半年是自2014年中報之后首次出現凈利潤負增長。營收高速增長55.06%,凈利潤為何不升反降? 復星醫藥表示,利潤下降主要系報告期內資產處置收益減少導致非經常性損益較上年同期減少人民幣 6113.32 萬元,以及經常性損益較上年同期減少人民幣6745.57 萬元所致,經常性損益的減少則是受創新研發和業務布局的投入上升,以及利息費用增加等因素影響。 值得注意的是,復星醫藥并未將研發投入全部費用化,對4.79億元左右的研發投入進行了資本化處理,資本化率接近40%,為近五年來最高值,這在一定程度上減輕了研發投入對盈利的不利影響。 這些總比研發費不及銷售費的五分之一的長生強不少。[詳情]
Copyright ? 1996-2018 SINA Corporation, All Rights Reserved
新浪公司 版權所有