來源:“十點科學”微信公眾號
病毒變異給全球防疫不斷帶來一輪輪新的挑戰。變強之后的病毒,到底哪里不一樣了?

德爾塔變異株已在全球132個國家蔓延|news.cgtn.com
撰文/徐斯佳 ([日]京都大學醫學院)
最近,新冠病毒德爾塔(Delta)變異株在國內的跨省傳播引發高度關注。其實該病毒在全球范圍內已經傳播很長時間了。
德爾塔變異株病毒載量高、傳播能力強、傳播速度快,轉陰時間長。自2020 年10 月首次在印度出現以來,11個月的時間內已擴散至全球132個國家地區,導致多國新冠病例激增,對未接種疫苗人群的健康和全球經濟復蘇產生嚴重影響。(聯合國7月30日數據)
世界衛生組織流行病學家Maria van Kerkhove指出,德爾塔變異株的傳染力比2019年底首次出現的原始毒株高出約50%。
德爾塔變異株為何傳染性這么強?現有的疫苗還能保護我們嗎?
新冠病毒是怎么變異的
生物的親代和子代之間總有些差異,這是群體多樣性和進化發展所必須的。病毒雖然是自己復制自己,在此過程中基因也會發生頻繁的突變,產生變異株。這種突變原本是隨機的,效果也不確定。有些可能不會令病毒產生明顯變化;有些反而會使病毒變得更溫和;自然,也有一些會令病毒的傳播力、毒性都更強。
所謂“適者生存”。如果某些變異能讓病毒更容易感染宿主,或逃避免疫系統的攻擊,就有更多機會大量復制,產生同樣狡猾或強勢的子代。然后像滾雪球一樣,隊伍不斷壯大,對公共衛生造成新的威脅。
其實這種現象在病毒世界里普遍存在。一個典型例子就是艾滋病病毒HIV。正是因為HIV極高的突變率,令疫苗和治療藥的研發非常艱難。精心設計的作用靶點(即反應位置)很容易因病毒變異而失去預期效果。
再說回新冠病毒。我們知道,它們感染人體細胞的關鍵就是其表面的刺突蛋白(Spike Protein), 一般有24~40個,呈任意排列。它們像一把把“鑰匙”,錨定細胞上的“鎖”(受體分子)進入人體細胞,大肆復制、造成傷害。刺突蛋白也是疫苗研發的重點目標。
刺突蛋白的底部有像關節一樣的“鉸鏈”結構,又能令其靈活擺動、旋轉,增加蛋白與細胞接觸的機會;而蛋白頂端有多個與細胞結合的關鍵部位:受體結合域(RBD)。危險的變異株多在這里發生重要突變。
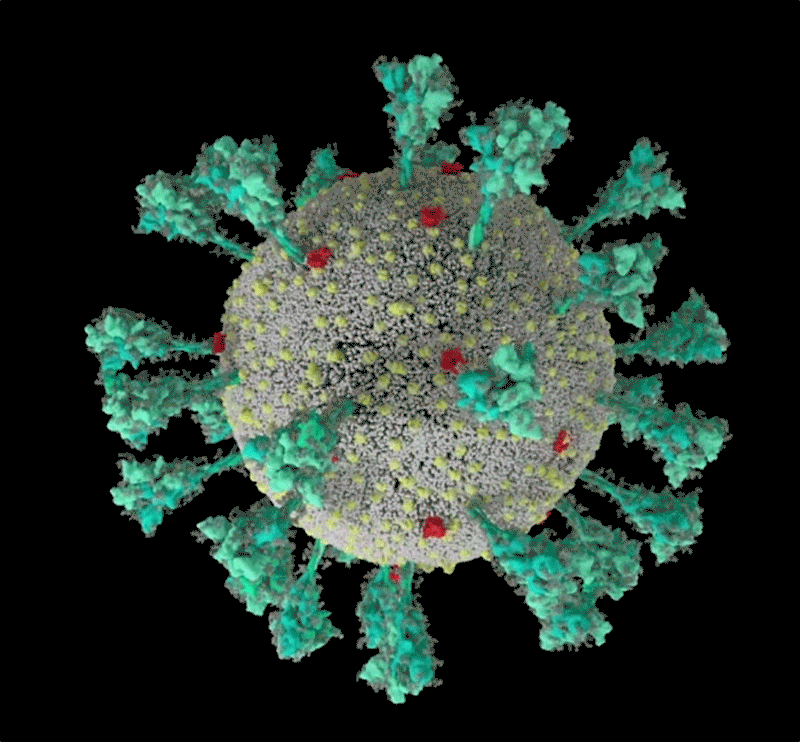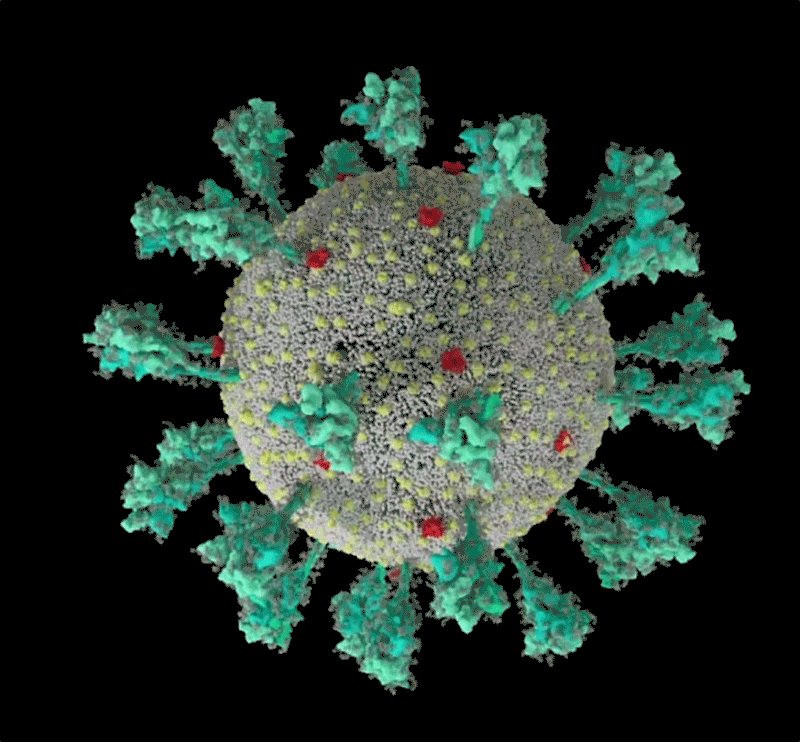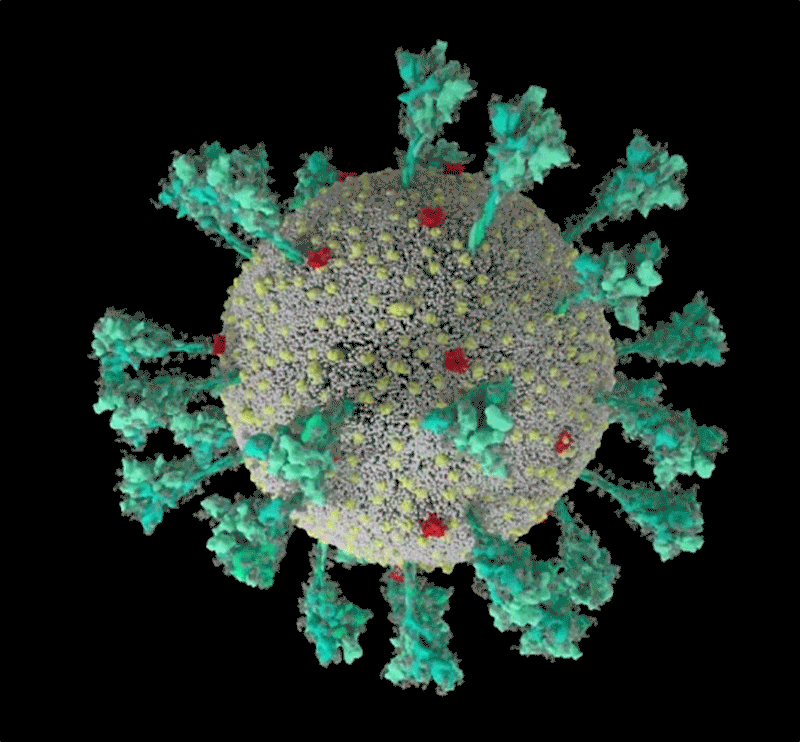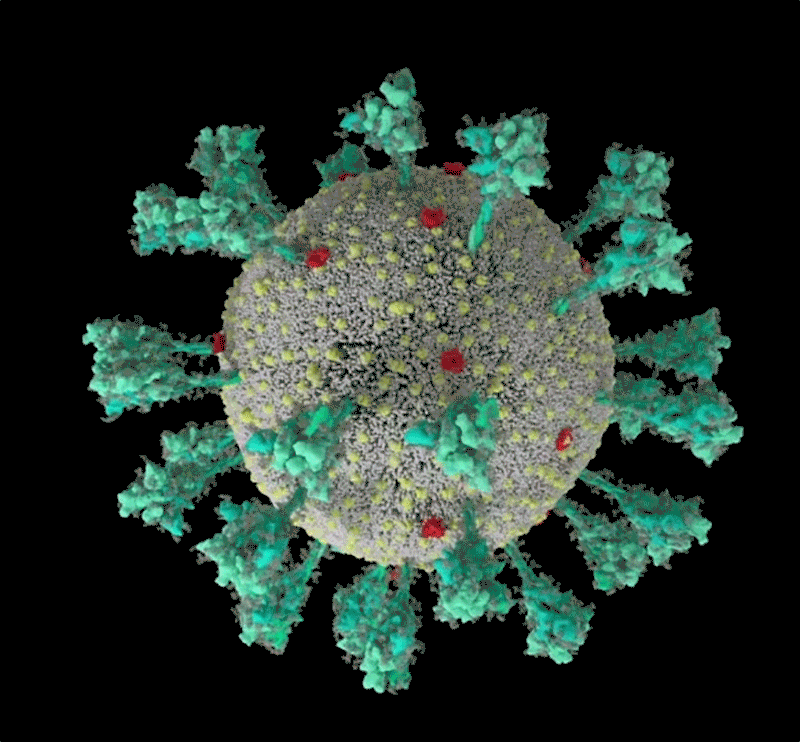
新冠病毒的計算機模擬結構, 綠色即為刺突蛋白。可以看出其形態非常多變,這讓它與人體細胞結合的方式也更加多樣。| University of Utah
“傳染王”德爾塔有何特別之處
根據危險程度不同,世衛組織將新冠變異毒株分成兩類:令人擔憂的變異株(VOC, variant?of?concern)和值得關注的變異株(VOI, variant?of?interest)。前者是指引發的病例多、范圍廣,并已有數據證實其傳播能力、毒性強,或導致疫苗和臨床治療有效性降低;后者則是雖在世界范圍內出現社區傳播病例,但尚未形成大規模傳染。
顯而易見,VOC對公共健康威脅較大,是需要重點應對的類型。其中包括:在英國占主導的阿爾法變異株(Alpha)、南非的貝塔(Beta)、巴西的伽馬(Gamma)和在印度率先發現的德爾塔(Delta)。按希臘字母命名的做法,是為了避免對變異株發現的國家造成污名化。
刺突蛋白頂部受體結合域的突變可能直接影響病毒入侵細胞的能力。有的突變能導致 RBD保持“向上”狀態不易坍塌,從而更容易進入細胞。德爾塔變異株的受體結合域上有 3 個突變,與細胞的親和力更強。作為比較,阿爾法變異株的傳播率比新冠病毒原始毒株高 50%,而德爾塔比阿爾法變種又高出約 60%。
不過,要做到傳染性強,容易進入細胞還不夠,病毒還得搶奪宿主細胞大量自我復制,以及具備逃避免疫系統打擊的本領。
人體的細胞工廠原本不是為了復制病毒服務的,每時每刻都在忙著自己的蛋白質合成。新冠病毒抵達細胞內部后首先合成一種病毒蛋白(Nsp1),它會切割不帶病毒標記的人體細胞的核酸(攜帶著基因信息),令需要完整信息才能產生的人體蛋白無法合成。
病毒把細胞工廠大肆占為己有,同時關閉細胞的預警系統。正常情況下,當細胞察覺到自己被感染,一部分特殊的基因會被激活,合成出能預警人體免疫系統的物質(如干擾素),釋放出去召喚救兵。而又是Nsp1蛋白,它能阻塞細胞核的通道,不讓那些核酸接觸細胞工廠,也就無法合成預警蛋白,更遑論向外呼救,免疫系統便很難注意到被感染細胞發出的求救指令。

狡猾的新冠病毒,不僅阻礙細胞正常蛋白質合成,還不讓“報警”|維基百科
德爾塔病毒變異株不僅繼承了所有這些詭計,成為“傳染王”的它還另有一絕招。
新冠病毒的刺突蛋白上下各亞基之間有個特殊的位點,稱為“弗林(Furin)切割位點”,因為它能被宿主細胞的弗林蛋白識別并切割。切割后,病毒顆粒的刺突蛋白會松開,暴露出里面和細胞膜性質相同的疏水性區域,將自己迅速與宿主細胞膜融為一體。普通冠狀病毒也有這個位點,但一般只有一個精氨酸。新冠病毒的此處卻是個由 5 個氨基酸(脯氨酸、精氨酸、精氨酸、丙氨酸、精氨酸)連成的“鏈子”,更容易被識別。

Furin蛋白酶的切割使刺突蛋白結構變得松散,因而能夠被一種名為TMPRSS2的蛋白酶識別并被繼續切割,從而暴露出其中的疏水氨基酸,進而得以快速進入細胞。圖為TMPRSS2蛋白酶切割刺突蛋白。|Nature
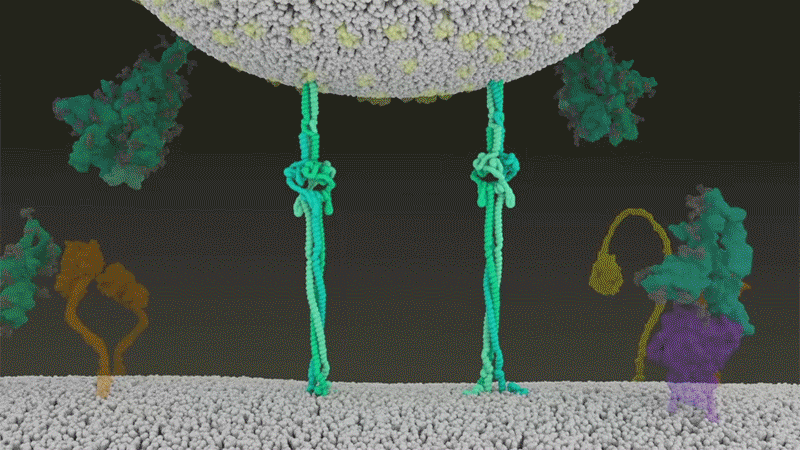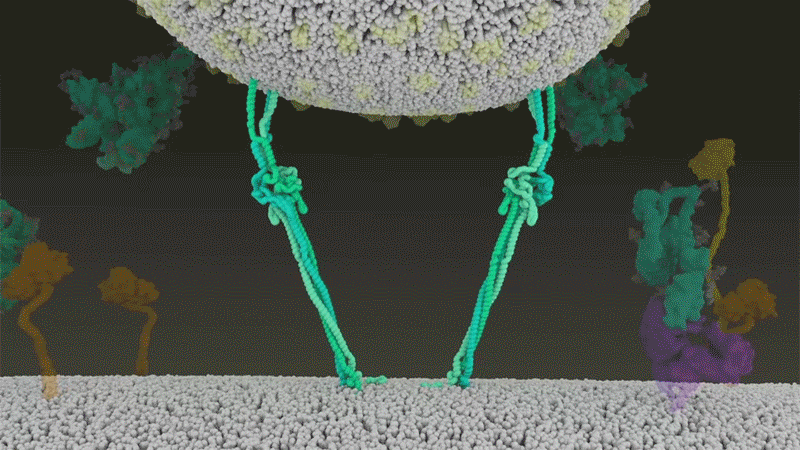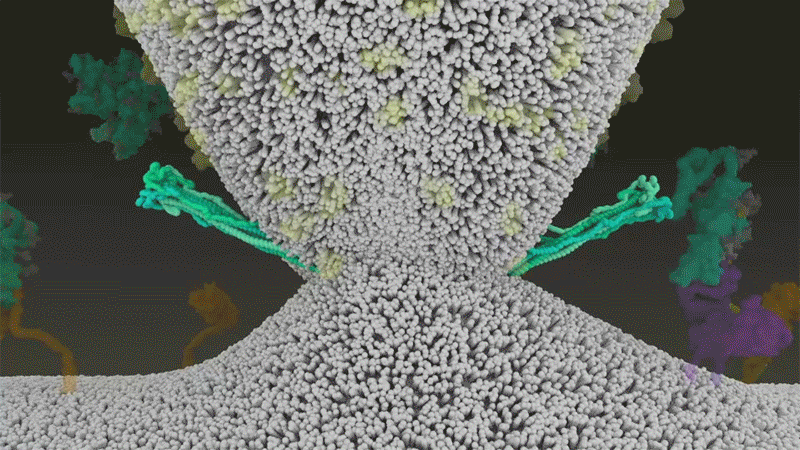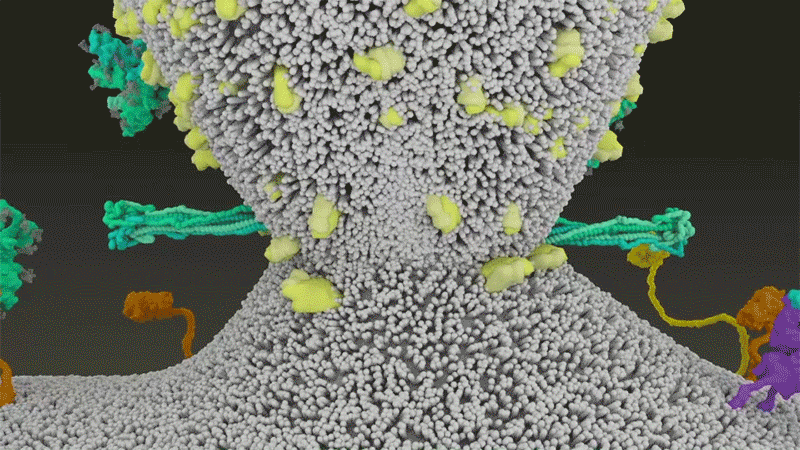
刺突蛋白附著在細胞膜上之后,通過折疊自身,拉扯病毒與細胞膜融合。|Nature
阿爾法和德爾塔變異株的弗林切割位點都發生了變化。前者將原來的脯氨酸替換成組氨酸;而德爾塔則替換成了精氨酸。這兩個變化都會減少這條“鏈子”的酸性。氨基酸鏈的堿性越高,切割的效果越好。更多切割意味著更多刺突蛋白準備好進入人體細胞。SARS病毒只有不到 10% 的刺突蛋白做好了這種準備,阿爾法毒株超過了50%,而德爾塔變異株這一比例高達75% 以上,成為其超強傳染能力的重要原因。
所幸,傳染性更高并不意味著更致命。目前數據表明德爾塔變異株雖然更容易攻擊50歲以下的較年輕的人群,使多地住院率上升。但并沒有證據支持其更致命。
完善疫苗接種有助于抵抗變異株
眼下主流的疫苗如滅活疫苗、核酸疫苗,基礎免疫程序均為2劑次。各國正在對疫苗混搭、加打第三劑的方案展開研究,找出防范德爾塔變異株的有效策略。
7月初,德國衛生部下屬的常務疫苗委員會(STIKO)提議:已接種了第一針阿斯利康腺病毒載體疫苗的人群,第二針施打BioNTech/輝瑞或者莫德納的核酸疫苗可獲得 “極佳”的保護力,且間隔期可從12周縮短至最少4周,“這對于防范德爾塔變種蔓延有著重大意義”。
我國也在積極開展第三針加強針的效果研究。
7月25日,科興疫苗發布了一項研究結果(同行評審中)。該研究從2020年5月開始展開,共540名受試者參與。受試者被分為4組,先以14天和28天為間隔接種2劑科興滅活疫苗,再以28天和180天接種第3劑疫苗。
結果發現第三針可大幅提升人體免疫反應,中和抗體滴度較接種兩針后提高數倍。但針對變異株是否有相同效果仍待研究。

各國都在研究新的疫苗接種方案。|圖蟲創意
緊隨其后,美國輝瑞/BioNTech也公布了核酸疫苗BNT162b2的加強針數據,對于德爾塔變異株,成年組接種第三針后,抗體滴度由241升至1321,提高超過4倍;老年組中,抗體滴度從124上升至1479,提高超過10倍。
雖然接種第三針可使中和抗體滴度明顯提高,但目前相關方案還沒正式推廣。
當然,中和抗體數量并不是衡量疫苗好壞的唯一指標,人體免疫系統也并非對被感染的細胞束手無策。
美國克利夫蘭診所的一項樣本量超過5.2萬的研究發現:曾感染過新冠病毒的人,5個月內抵抗再次感染的能力與注射疫苗相當。對于未感染過的人們來說,完成疫苗注射,不僅能獲得可靠的防護,也有助于減少病毒的攜帶與傳播等(包括無癥狀感染者)。
鐘南山院士曾提醒,我國需要83.3%的接種率才能達到群體免疫,特別呼吁重視疫苗接種。
這是一場時間的競賽。在疫情大肆復燃,或更棘手的變異出現之前,應盡可能爭取讓更多人接種疫苗。其他話不多說,保持距離、戴好口罩。
(注:剛剛,一項新的研究指出,目前正在南美地區快速傳播的拉姆達變異株,與原始版本相比,具有高度傳染性,對疫苗的耐藥性也更強。有分析認為,按照目前的傳播趨勢,拉姆達有可能取代德爾塔,成為下一階段全球流行的優勢毒株。)
(責編 高佩雯)
參考資料
1.https://www.medrxiv.org/content/10.1101/2021.06.17.21259103v1
2.https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)01358-1/fulltext
3。Hoffmann M, Kleine-Weber H, P?hlmann S。 AMultibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential forInfection of Human Lung Cells。 Mol Cell。 2020 May 21;78(4):779-784.e5。 doi:10.1016/j.molcel.2020.04.022。 Epub 2020 May 1。 PMID: 32362314; PMCID: PMC7194065。

“掌”握科技鮮聞 (微信搜索techsina或掃描左側二維碼關注)

















